|
ACIDI E BASI: Definizione
Il termine "acido" deriva dal verbo latino "acere" che può essere tradotto in "essere aspro". Gli uomini conoscono da lungo tempo il sapore "acido" assieme ai tre sapori principali: "dolce", "salato" e "amaro". La scienza ha dovuto faticare non poco per definirne le caratteristiche chimiche e strutturali. Ecco una breve cronistoria: Nel 1661 Robert Boyle diede una prima definizione di acidi e basi (o alcali): Antoine Lavoisier fu il primo a considerare la natura chimica degli acidi. In base agli studi che aveva effettuato, credeva che tutti gli acidi contenevano ossigeno (la parola ossigeno, derivante dal greco, significa appunto generatore di acidi: oxus="acido" e gennan="generare"). Nel 1811 Humphry Davy dimostrò che quanto asserito da Lavoisier non era del tutto vero per il fatto che il cloruro di idrogeno si comportava da acido pur non contenendo ossigeno: ben presto vennero preparati altri acidi che non contenevano ossigeno (H2S, HCN etc.) Nel 1838 Justig Liebig, studiando gli acidi organici, suggerì che gli acidi avessero uno o più atomi di idrogeno che sostituiti da un metallo generassero sali.
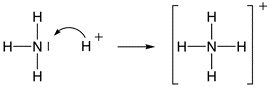
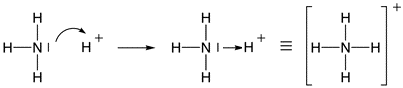
DEFINIZIONE DI ARRHENIUS Nel 1884 il chimico e fisico svedese Svante August Arrhenius propose la teoria della dissociazione elettrolitica, secondo la quale parecchie sostanze, come ad esempio i sali, gli acidi e le basi si sciolgono in acqua con la formazione di particelle cariche dette ioni. Gli ioni erano stati teorizzati per la prima volta da Michael Faraday attorno al 1830 per spiegare la conduzione nei sistemi elettrolitici: egli pensava che si formassero dopo l'applicazione di un campo elettrico. La parola "ione" deriva dal greco ion, participio presente di ienai "andare", quindi "andante".
Nel caso in cui un acido o una base risulta debole si ricorre al consueto simbolismo della doppia freccia ad indicare l'equilibrio dovuto alla parziale dissociazione. La teoria di Arrhenius, ancora utlilizzata in molti casi per la sua semplicità, spiegava molte cose riguardo il comportamento degli acidi e delle basi, ma aveva dei seri limiti:
DEFINIZIONE DI Brønsted-Lowry Nel 1923 Johannes Nicolaus Brønsted (danese) e Thomas Martin Lowry (inglese), contemporaneamente ed indipendentemente l'uno dall'altro, proposero una definizione di acido e di base nota come teoria di Brønsted-Lowry che, pur includendo la teoria di Arrhenius, ne superava alcuni limiti (in seguto, per brevità userò solo il nome di Brønsted). Ecco le loro definizioni:
Supponiamo di avere il substrato 1 che ha la possibilità di cedere o perdere un protone ad un substrato 2 capace di accettare un protone. Evidenziamo le due capacità visualizzando il protone per la specie 1 e una coppia di elettroni per la specie 2 1-H + 2: Dopo il trasferimento del protone la specie 1 si impoverisce di una carica positiva (se inizialmente neutra diventa negativa) mentre la specie 2 si arricchisce, oltre che del protone, anche della carica positiva trasportata dal protone stesso. Se il trasferimento protonico non è totale ma riguarda un sistema all'equilibrio, la reazione inversa avviene con il trasferimento protonico in senso inverso. Questo fatto significa che il substrato 1 senza protone si comporta da base, mentre il substrato 2 con il protone si comporta da acido. Queste ultime due specie vengono dette rispettivamente base coniugata e acido coniugato dei due substrati da cui sono derivati. 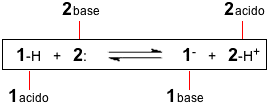 La teoria comprende gli acidi di Arrhenius ma il protone, non più libero, sarà trasferito al solvente acqua formando lo ione idronio. Ad esempio, per l'acido nitroso in acqua: HNO2 (aq) + H2O(l) Evidenziamo il trasferimento protonico nella reazione diretta e inversa: 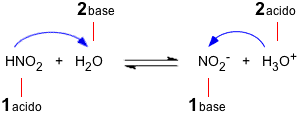 Nella reazione verso destra l'acido nitroso trasferisce il protone alla base acqua, diventando anione nitrito, mentre l'acqua che ha ricevuto il protone diventa ione idronio o idrossonio. Nella reazione verso sinistra è lo ione idronio che si comporta da acido trasferendo un protone allo ione nitrito che agisce da base. Le due coppie acido-base coniugate sono evidenziate nella figura. Consideriamo adesso l'ammoniaca in acqua. Questa sostanza non è facilmente interpretabile come base secondo Arrhenius, mentre secondo Brønsted: NH3 (aq) + H2O(l) Evidenziamo il trasferimento protonico nella reazione diretta e inversa tra le coppie coniugate: 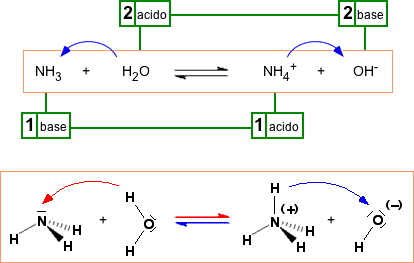 Nei due esempi proposti, acido nitroso in acqua e ammoniaca in acqua, si può notare come l'acqua si comporti in maniera differente a seconda del partner: questo tipo di sostanze si chiamano "anfotere" (dal greco "l'uno e l'altro di due"). Secondo Brønsted una specie chimica non dovrebbe essere definita a priori "acido" oppure "base", nel senso che una sostanza non è un acido perchè è nata acido, ma diventa tale quando trasferisce un protone ad un'altra sostanza che si comporta da base. Il discorso si inverte nel caso ci si voglia riferire ad una base. Altri esempi di sostanze anfotere sono gli ioni idrogenocarbonato e idrogenosolfuro.
FORZA DEGLI ACIDI E DELLE BASI Se un acido o una base sono stati definiti secondo Arrhenius, la loro forza si riflette nel grado di dissociazione. Un acido forte tende a dissociarsi completamente mentre un acido debole tende a dissociarsi più o meno parzialmente in funzione della sua concentrazione (legge di diluizione di Ostwald). In termini quantitativi e indipendenti dalla concentrazione, la forza di un acido o di una base, viene espressa dalla costante di dissociazione in acqua (o di reazione con l'acqua).
La forza di un acido o di una base, a parità di solvente, dipende fondamentalmente dalla sua struttura chimica ed è un complesso problema termodinamico che al momento evitiamo di trattare in maniera quantitativa. A titolo puramente indicativo, per gli acidi di Brønsted (acidi protici), si può facilmente notare che la maggior presenza gruppi elettron attrattori nella molecola rende un acido più forte perchè consente una maggiore stabilità della base coniugata che può meglio sopportare la carica negativa in eccesso dovuta alla perdita del protone:
Il ruolo del solvente non è trascurabile, in quanto l'effetto stabilizzante della solvatazione sulla base coniugata può anch'esso influenzare l'equilibrio della reazione di trasferimento protonico. NOTA: le notazioni date agli acidi o alle basi "debole", "molto debole", "forte", "medio forte" etc. sono solo indicative. Storicamewnte prendono come riferimento l'acido acetico definito come "debole". Trattandoli come sostanze che producono ioni (elettroliti), la loro forza è semplicemente la costante di reazione con il solvente.
DEFINIZIONE DI Gilbert Lewis Nello stesso anno (1923) di Brønsted e Lowry, il chimico americano Gilbert Newton Lewis propose una teoria più generale di acido e di base, in grado di definire acidi e basi anche per reazioni che non avvengono in soluzione oppure senza che vi sia trasferimento protonico.
La definizione di Lewis, ovviamente, include gli acidi e le basi di Brønsted che riguardano le reazioni di trasferimento protonico. Ad esempio, l'ammoniaca (base) reagisce con l'acido cloridrico formando il sale cloruro di ammonio secondo il seguente schema di reazione: 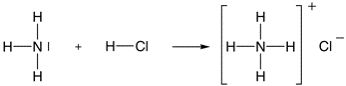 (a) Secondo Brønsted l'acido cloridrico trasferisce il suo protone alla base. (b) Secondo Lewis l'ammoniaca riesce a formare lo ione ammonio donando una coppia di elettroni al protone proveniente dall'acido cloridrico in quanto quest'ultimo ha la disponibilità ad accogliere una coppia di elettroni nell'orbitale 1s:
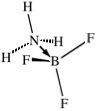
Così ancora, secondo la definizione di Brønsted l'ammoniaca si comporta da base in acqua perchè accetta un protone dall'acqua formando lo ione ammonio; secondo Lewis, l'ammoniaca riesce a formare lo ione ammonio donando una coppia di elettroni ad un protone proveniente dall'acqua. Il risultato, comunque, in termini netti è sempre lo stesso: NH3 (aq) + H2O(l) Rientrano nella definizione più generale di acido e base di Lewis alcune sostanze che reagiscono senza scambiarsi protoni e che pertanto non potrebbero essere inquadrate nella classificazione di Brønsted e di Arrhenius. Vediamone alcuni esempi. Un primo esempio, già visto a proposito del legame dativo, riguarda la formazione dell'addotto tra ammoniaca e il trifluoruro di boro. La reazione avviene senza scambio di protoni tra un acido e una base di Lewis. L'ammoniaca funge da base di Lewis e dona il doppietto elettronico al trifluoruro di boro che lo accetta nell'orbitale p vuoto non ibridizzato (click su una figura per osservare il modello 3D interattivo).
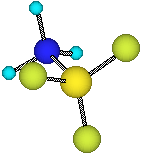
Altri esempi riguardano molti cationi dei metalli (specie quelli di transizione che hanno orbitali vuoti a bassa energia come Cu2+ o Ag+), che vengono coordinati dal solvente, spesso acqua, per formare solvospecie che poi possono comportarsi da acidi nei confronti dell'acqua. Il legame che si instaura è di tipo dativo o di coordinazione (donazione di un doppietto da parte dell'acqua) Al3+(aq) + 6 H2O(l) In altri termini possono definirsi acidi di Lewis quelle specie chimiche del tipo BF3, AlCl3, Al(OH)3, H+, Na+, SO4- -, tutte strutture che presentano la possibilità di ospitare doppietti elettronici; si possono considerare basi di Lewis quelle specie chimiche del tipo NH3, OH-, H2O, Cl-, F-, tutte strutture che possiedono un "Lone pair", disponibili a donarlo per costituire un legame dativo.
ACIDI POLIPROTICI Gli acidi poliprotici sono acidi che contengono più protoni dissociabili (o che possono essere donati ad una base). Anche alcune basi possiedono la caratteristica opposta. Seguono dei classici esempi di acidi poliprotici (acido solfidrico, acido solforico e acido fosforico) e gli anioni derivanti dalle successive dissociazioni:
Questi acidi cedono i loro protoni in stadi successivi. Per ciascuno stadio si osserva una costante di equilibrio K1, K2, K3..... Le costanti di equilibrio successive sono sempre più piccole. Se i protoni si staccano da gruppi molto vicini, generalmente le costanti successive risultano oltre 10000 volte minori, se i protoni si staccano da punti "lontani" la differenza tra due costanti successive risulta minore.
Vediamo adesso un acido molto particolare. Si tratta del diossido di carbonio. il gas si scioglie in acqua in maniera relativamente lenta, con una solubilità pari a circa 0.034 mol dm-3 a 25°C e alla pressione parziale di CO2 pari ad 1 atm. Nella nostra atmosfera la pressione parziale di CO2 risulta (mediamente e problemi locali permettendo) pari a 3.6×10-4 atm. Il CO2 sciolto in acqua da luogo a una serie complessa di equilibri con la presenza di:
Spesso i valori tabulati nei libri sono diversi (soprattutto nei riguardi della prima costante) perchè sono riferite alla quantità iniziale di CO2 e non all'acido carbonico presente in soluzione. Siccome la quantità in moli di CO2 è molto maggiore rispetto a quella dell'acido carbonico, quest'ultimo, in maniera apparente, risulta meno forte di quello che è in realtà (nota la differenza tra le K 1):
La prima reazione dovrebbe scriversi nel modo seguente:
Nei mammiferi è necessario un rapido scembio tra diossido di carbonio e acido carbonico (quest'ultimo in realtà è in parte dissociato e pertanto presente sotto forma di idrogenocarbonato). Lo scambio veloce è assicurato dall'accelerazione del processo grazie al catalizzatore enzimatico denominato Anidrasi Carbonica (CA). Così come esistono gli acidi polifunzionali (poliprotici), esitono anche le basi polifunzionali che possono accettare più di un protone. |
||||||||||||||||||||||||||||||||||||||||||||||||||||