Legame ad elettroni delocalizzati
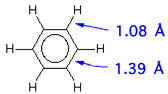
L'esempio più eloquente é rappresentato dal benzene. In prima
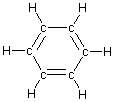
battuta si può rappresentare il benzene, di formula bruta C6H6,
come una struttura planare ad esagono regolare (angolo interno
di 120°) con doppi legami alternati. Questa geometria può derivare dalla ibridizzazione sp2 degli atomi di carbonio e dalla successiva localizzazione dei doppi legami che si dispongono alternati per sovrapposizione ![]() degli orbitali p di ogni atomo di carbonio rimasti non ibridizzati. (la diversa colorazione serve solo per identificare le coppie di orbitali che si intendono sovrapposti)
degli orbitali p di ogni atomo di carbonio rimasti non ibridizzati. (la diversa colorazione serve solo per identificare le coppie di orbitali che si intendono sovrapposti)
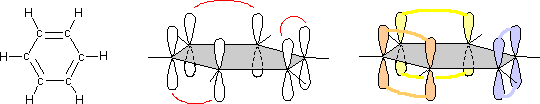
Ma é pur vero che la sovrapposizione può avvenire diversamente, localizzando i doppi legami in posizioni diverse:
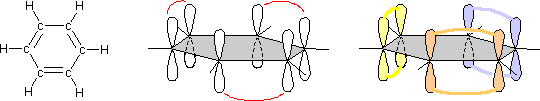
Nessuna delle due strutture può essere quella vera. Infatti i doppi legami hanno una lunghezza minore dei legami semplici carbonio-carbonio e questo impedirebbe al sistema di essere rappresentato come un esagono regolare. Per definire la reale struttura del benzene si usa invocare il concetto di risonanza, considerando il benzene come l'ibrido di risonanza tra le due formule limiti:
In questa maniera i legami sono tutti uguali con un ordine unico (1.5) rispetto ai due diversi presenti nelle formule limite (1 e 2 ovvero legame semplice e doppio)
Un'altra possibilità é quella di considerare la completa delocalizzazione delle cariche elettroniche presenti da una parte e dall'altra rispetto al piano su cui giacciono gli atomi di carbonio, una sorta di orbitale coinvolgente l'intera dimensione molecolare:
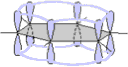
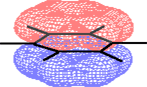
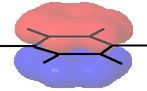
Spesso, per il benzene e per i suoi derivati, considerando la suddetta delocalizzazione, si usa la seguente formula provvista di un cerchio simboleggiante la delocalizzazione elettronica:
Sia in termini di risonanza che in termini di delocalizzazione ![]() ,
il risultato è che il benzene ha una struttura dotata di grande
stabilità termodinamica.
,
il risultato è che il benzene ha una struttura dotata di grande
stabilità termodinamica.
In termini di orbitali molecolari, la zona simmetrica di
delocalizzazione considerata rappresenta solo uno dei sei
orbitali molecolari possibili ed è quello ad energia
più bassa.
LEGAME DATIVO O DI COORDINAZIONE
Un legame covalente si ottiene quando due atomi condividono una coppia di elettroni. La forza attrattiva deriva dal fatto che gli elettroni sono attratti da entrambi i nulcei e dall'energia di scambio che ne deriva. Nel normale legame covalente ogni atomo impegnato nel legame fornisce un elettrone. Il legame dativo o di coordinazione differisce per il fatto che entrambi gli elettroni condivisi derivano dallo stesso atomo o gruppo atomico. Viene spesso indicato, in fase di formazione, da una freccia che parte dall'atomo donatore e raggiunge l'atomo accettore della coppia di elettroni.
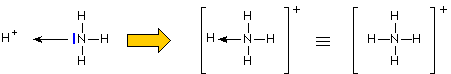
Formazione dello ione ammonio
Se l'ammoniaca va a contatto con il protone (ottenuto ad esempio dalla dissociazione di una specie acida) si forma lo ione ammonio a struttura tetraedrica. La reazione avviene anche a livello gassoso, ad esempio per reazione con il cloruro di idrogeno (gas) si ottiene un solido bianco:
Il protone presenta un orbitale vuoto, mentre l'ammoniaca dispone di una coppia di elettroni non impegnata in legame (Lone pair). Si può pensare che l'ammoniaca metta in conpartecipazione con il protone tale doppietto elettronico con la formazione di un legame covalente dativo. Una volta che si é formato, non sarà più possibile distinguere il legame dativo dagli altri, in quanto la carica positiva risulta equamente delocalizzata nell'intero ione.
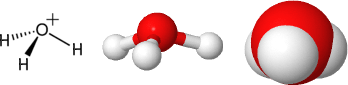
Formazione dello ione idrossonio (o ossidanio, obsoleto: idronio)
Si tratta di un particolare ossonio; strutturalmente è una piramide trigonale con angolo HOH di circa 112°, simile all'ammoniaca ma con forma più schiacciata tendente verso la planarità (NOTA: con l’angolo che sarebbe di 120°).
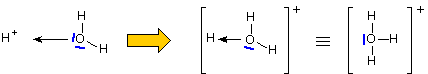
Viste prospettiche del modello dello ione idronio:
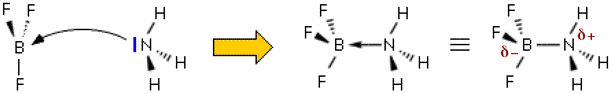
Formazione dell'addotto ammoniaca-trifluoruro di boro
Il triflururo di boro é una specie carente di
elettroni (ottetto non raggiunto) e possiede un orbitale p
non ibridizzato sull'atomo di boro in grado di accettare una
coppia di elettroni. Quandoil BF3 reagisce con NH3, e si forma il legame, la
struttura del boro da planare che era, diventa
tetraedrica (click sulla figura seguente per osservare il modello 3D interattivo). Anche in questo caso si ha la formazione di un composto solido a partire da due reagenti gassosi.
(p.f. ammoniaca-trifluoruro di boro = 104°C).
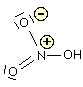
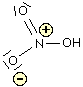
Acido nitrico
La figura che segue mostra l'acido nitroso (a sinistra) e l'acido nitrico (a destra).
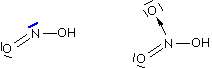
Molti autori considerano, a ragion veduta, piuttosto fuorviante la struttura dell'acido nitrico indicata in questo modo in quanto sembrerebbe che i due atomi di ossigeno siano legati differentemente all'azoto. Per indicare la reale struttura si ricorre agli ibridi di risonanza oppure considerando la delocalizzazione degli elettroni di legame. Nelle fomule di risonanza il legame dativo viene indicato come un legame semplice ma con localizzazione di carica negativa sull'atomo accettore e positiva sull'atomo donatore: