Legami deboli o interazioni deboli
La forza di un legame chimico viene stabilita in base alla energia del legame (corrispondente all'energia necessaria per spezzarlo):
| Tipo di legame | energia di legame (kj/mole) | energia di legame (kcal/mole) |
| Legami forti (ionici o covalenti) | 100 ÷ 1000 | 24 ÷ 240 |
| Legami deboli | 0.1 ÷ 30 | 0.024 ÷ 7.1 |
ALCUNE ENERGIE DI LEGAME
| Tipo di legame | Energia (kj/mole) | Energia (kcal/mole) |
| C-H | 415 | 99 |
| C-C (singolo 1.54 Å) | 347 | 83 |
| C-C (doppio 1.34 Å) | 610 | 145 |
| C-C (triplo 1.20 Å) | 836 | 200 |
| C-C (benzene 1.39Å) | 518 | 124 |
| C-F | 485 | 116 |
| C-Cl | 328 | 78 |
| C-Br | 276 | 66 |
| C-I | 240 | 57 |
| C-N | 293 | 70 |
| C-O | 358 | 85 |
| H-H | 435 | 104 |
| H-F (0.92 Å) | 570 | 136 |
| H-Cl (1.27 Å) | 431 | 103 |
| H-Br (1.41 Å) | 364 | 87 |
| H-I (1.61 Å) | 297 | 71 |
| O-H | 463 | 110 |
| N-H | 389 | 93 |
Tipi di interazioni deboli
Le interazioni deboli, essenzialmente di natura elettrostatica, si realizzano "tra"
le molecole o specie chimiche già costituite con legami di tipo covalente (spesso indicate come forze
intermolecolari), oppure "tra" parti diverse di una singola molecola
generalmente piuttosto grande. Le aree interessate alle forze di attrazione devono
essere, tendenzialmente, cariche di segno opposto.
Le molecole si possono attrarre vicendevolmente solo a distanza ravvicinata.
Tali forze attrattive, dette genericamente “forze di van
der Waals” sono meno intense di quelle che si realizzano nei legami covalenti
e, già a temperature relativamente basse, queste deboli interazioni di legame
persistono per tempi molto brevi.
Per quanto le forze intermolecolari siano dotate di scarsa energia, la loro esistenza
è fondamentale nel determinare gli stati di aggregazione delle sostanze e sono
anche responsabili di altre notevoli proprietà dei composti molecolari, come
ad esempio la loro struttura cristallina, il punto di fusione, il punto di ebollizione,
i calori di fusione e di vaporizzazione, la tensione superficiale e la densità.
Le forze intermolecolari, in aggiunta a quanto detto, giocano un ruolo importante
nello stabilizzare le forme tridimensionali delle macromolecole biologiche (enzimi
e proteine). Lo "shape" di tali macromolecole è spesso indispensabile
per una corretta esplicazione dell'attività fisiologica.
Le forze intermolecolari possono essere PERMANENTI o TRANSITORIE. Le
prime sono dovute all’interazione di specie chimiche contenenti gruppi permanentemente
poveri di elettroni e altrettante zone elettron-ricche (molecole dipolari): in questa
categoria rientra il legame idrogeno. Le seconde si presentano grazie ai moti
termici in grado di provocare rapide oscillazioni delle nuvole elettroniche che determinano
la formazione di dipoli momentanei.
Interazioni DIPOLO - DIPOLO
Tutte le molecole tra le quali esiste questo tipo di interazione sono polari (Dipoli Permanenti) e tendono ad orientarsi disponendosi testa-coda con il risultato di una forza attrattiva (esempi: H2O*, H2S, HCl, SO2). Allo stato gassoso, quando le molecole si avvicinano a sufficienza, l'interazione dipolare tende a manifestarsi, ma spesso non è in grado di legare permanentemente le molecole perchè queste sono dotate, a quella temperatura, di una quantità di moto sufficiente a prevenire la formazione di agglomerati stabili (condensa).
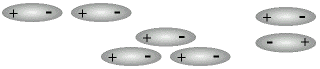 |
Possibili disposizioni 2D nella interazione attrattiva tra dipoli permanenti |
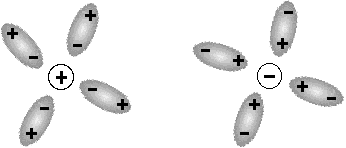 |
Un dipolo permanente può interagire fortemente con uno ione; ad esempio gli ioni in soluzione acquosa sono fortemente solvatati (l'acqua è un dipolo permanente) ed il legame che si instaura contribuisce a determinare alcune proprietà termodinamiche delle soluzioni stesse (modello 3D). |
Interazioni DIPOLO - DIPOLO INDOTTO
Si instaurano tra molecole polari e altre apolari ma che risultano facilmente polarizzabili per induzione da parte delle molecole polari. L'intensità del legame dipende dalla polarizzabilità delle molecole (vedi oltre).
Interazioni DIPOLO ISTANTANEO - DIPOLO ISTANTANEO (forze di dispersione di London)
Si instaturano tra molecole apolari. Le forze di legame sono dovute alla distorsione
momentanea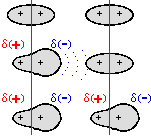 della nuvola elettronica che si propaga per induzione alle molecole circostanti. Nella
figura a destra vengono illustrati, molto sommariamente, tre brevi istanti in successione
per raffigurare la formazione del dipolo istantaneo-dipolo istantaneo indotto nel
caso di una molecola biatomica omonucleare. La formazione dei dipoli e di quelli indotti
persiste per tempi dell'ordine di 10-14 o 10-15 secondi ma sufficiente
per produrre una netta forza di natura attrattiva.
della nuvola elettronica che si propaga per induzione alle molecole circostanti. Nella
figura a destra vengono illustrati, molto sommariamente, tre brevi istanti in successione
per raffigurare la formazione del dipolo istantaneo-dipolo istantaneo indotto nel
caso di una molecola biatomica omonucleare. La formazione dei dipoli e di quelli indotti
persiste per tempi dell'ordine di 10-14 o 10-15 secondi ma sufficiente
per produrre una netta forza di natura attrattiva.
Come già detto per le forze dipolo-dipolo indotto, anche l'entità di
questa interazione dipende dalla polarizzabilità delle molecole. Il dato semiquantitativo
indica che la polarizzabilità, e quindi l'intensità dell'interazione,
cresce nell'ordine He, H2, F2, Cl2, Br2,
I2.
| Alle molecole molto simmetriche e rigide (dette "hard"), come quelle monoatomiche dei gas nobili, é associata una energia di attrazione elettrostatica, dovuta alle forze di dispersione di London, di appena pochi decimi di kilocaloria per mole, con il risultato di una interazione veramente debole (a temperatura ambiente sono nello stato aeriforme). Se raffreddati a sufficienza, i gas nobili diventano liquidi: la loro temperatura di ebollizione aumenta scendendo lungo il gruppo perchè in tal senso aumentano le forze di dispersione di London. | Elem. | Teb / K | Teb /°C |
|
He Ne Ar Kr Xe Rn |
4.3
27.1 87.5 120.3 166.1 211.4 |
-268.9
-246.1 -185.7 -152.9 -107.1 -61.8 |
Nel caso degli alogeni, la variazione graduale del loro stato di aggregazione, da uno stato meno condensato ad uno più condensato, è in accordo con l'incremento dei valori di polarizzabilità che si hanno scendendo lungo il gruppo.

|

|

|
|
Cloro (gas)
|
Bromo (liquido e vapori)
|
Iodio (solido e vapori)
|
Polarizzabilità
La polarizzabilità di un atomo o di una molecola si riferisce principalmente
alla facilità con cui gli elettroni possono essere spostati dalla loro posizione
media. Gli elettroni interessati sono quelli di valenza, meno fortemente legati ai
nuclei. Se si considerano gli elementi di un gruppo di non metalli, la polarizzabilità
aumenta scendendo lungo il gruppo a causa della maggiore distanza dal nucleo e all'opera
di schermo degli elettroni nei gusci più interni. Questo concetto si estende,
nella maggioranza dei casi, anche alle dimensioni delle molecole, nel senso che le
molecole di maggiori dimensioni presentano maggiore polarizzabilità