|
ACIDI E BASI: pH e scala di pH
DISSOCIAZIONE O AUTOPROTOLISI DELL'ACQUA L'acqua ultrapura presenta una minima conduttività elettrica (0.055 micro-Siemens/cm a 25°C) dovuta certamente alla presenza di ioni in soluzione. Se si ragiona secondo la definizione di Arrhenius, si può ritenere che l'acqua subisce una dissociazione molto parziale del tipo: H2O(l) Mentre in termini di Brønsted-Lowry, più corretti e appropriati, l'acqua subisce una autoprotolisi, nel senso che alcune (pochissime) molecole di acqua trasferiscono un protone ad un'altra molecola d'acqua con la formazione di ioni idrossido e idrossonio (o ossidanio, obsoleto: idronio): H2O(l) + H2O(l) Trattandosi di acqua pura, la sua concentrazione è un ben preciso valore costante pari a 55.555 mol/L (in termini termodinamici rigorosi: la sua attività è unitaria), e pertanto non viene inclusa nell'espressione della costante di equilibrio che verrà rappresentata dal prodotto aritmetico della concentrazione degli ioni idrossido e idrossonio (prodotto ionico dell'acqua):
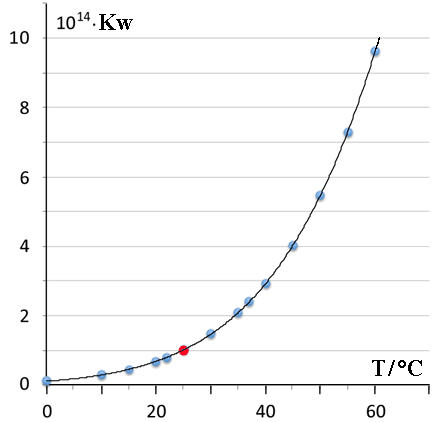
Kw = [OH-] [H3O+] La costante di equilibrio di autoionizzazione o autoprotolisi Kw dell'acqua (determinata sperimentalmente per la prima volta nel 1894) assume valori dipendenti dalla temperatura ed in particolare si osserva che il suo valore aumenta all'aumentare della temperatura:
In acqua pura, a 25°C, le concentrazioni degli ioni H3O+ e OH-, in base alla stechiometria del processo, devono avere lo stesso valore (condizione di neutralità): Kw = [OH-] [H3O+] = 1.0×10-7 x 1.0×10-7 = 1.0×10-14 Pertanto, nell'acqua pura, risulta dissociata pressapoco una molecola su 500 milioni, ovvero 2 molecole su 500 milioni sono interessate al trasferimento di un protone. Si tenga presente che si tratta di un equilibrio chimico e che gli scambi protonici avvengono continuamente nei due versi e che, di norma, i trasferimenti protonici sono molto veloci in termini di costante cinetica. Nel 1904 H. Friedenthal considerando l'interdipendenza tra i valori di [OH-] e [H3O+] raccomandò l'utilizzo del valore della concentrazione protonica per caratterizzare l'acidità o la basicità delle soluzioni. La tabella seguente illustra la relazione quantitativa tra [H3O+] e [OH-] in acqua:
pH = - log10 [H3O+]
Le lettere "pH" stavano ad indicare l'iniziale di "potential hydrogen". Il
segno negativo che precede il logaritmo decimale consente di rendere positivi
i valori ottenuti per il pH nei normali casi, cioè quelli
con valori della concentrazione protonica in soluzione <1.0 molare.
p = - log10 Così, ad esempio, per una costante di equilibrio si usa il pK, per [OH-] si usa pOH e per Kw si usa il pKw. La IUPAC, la cui ultima raccomandazione risale al 2002, definisce il pH in termini di una quantità misurabile, seppure con una relativa difficoltà, che viene chiamata attività dello ione H3O+ pH = - log10 a[H3O+] = - log10 (H3O+) L'attività indica la concentrazione attiva, non la concentrazione reale; il suo valore tiene conto degli altri ioni presenti in soluzione e di altre condizioni ambientali che agiscono come schermo e che alterano l'abilità della specie a partecipare alle reazioni chimiche o a produrre un certo fenomeno. Nel nostro corso e per i nostri esercizi useremo la terminologia classica. Dall'espressione della costante di dissociazione dell'acqua (Kw = [OH-] [H3O+]), applicando l'operatore "p" ad entrambi i membri, si ottiene la mutua relazione tra pH e pOH: pKw = pH + pOH = 14 La tabella seguente, commentata in aula, illustra la relazione tra [H3O+], [OH-], pH e pOH in acqua:
RELAZIONE TRA LA FORZA DI UN ACIDO (Ka) E LA FORZA DELLA SUA BASE CONIUGATA (Kb) NEL SOLVENTE ACQUA Si consideri, in acqua, l'acido debole CH3COOH (acido acetico). Esso tende a reagire parzialmente con l'acqua dando lo ione idronio e la sua base coniugata (ione acetaato): CH3COOH(aq) + H2O(l) La forza dell'acido acetico, ovvero la sua costante di dissociazione acida in acqua (Ka), è definita come
La base coniugata dell'acido acetico, l'anione acetato, in acqua si comporta ovviamente da base CH3COO-(aq) + H2O(l) La sua forza (non definibile in termini di dissociazione, perchè base di Brønsted e non di Arrhenius) Kb è definita come
moltiplicando la (1) per la (2) otterremo la relazione generale esistente tra la forza di un acido e la sua base coniugata nel solvente acqua:
L'espressione (3) è valida per qualunque coppia coniugata acido-base in acqua. Pertanto, noto uno dei due valori, l'altro è facilmemte ottenibile dalla semplice relazione (3). In termini relativi e non assoluti si può affermare che tanto più debole è un acido, tanto più forte tende ad essere la sua base coniugata (e viceversa).
Un altro esempio molto comune è la relazione esistente tra la base ammoniaca ed il suo acido coniugato che è lo ione ammonio:
MISURAZIONE DEL pH Come vedremo più in là, conoscendo la composizione di una soluzione, è possibile calcolarne il pH. Tuttavia, mediante certe sostanze dette indicatori, siamo in grado di verificare se il pH è maggiore o minore di un ben preciso valore; tale valore è specifico della sostanza che funge da indicatore. Esistono delle cartine imbevute di particolari miscele che permettono di verificare il pH con l'errore di circa mezza unità. La misura si ottiene confrontando il colore che assume uno spezzone di cartina quando viene a contatto con la soluzione da verificare, con quello presente sulla parte esterna del contenitore fornito dal costruttore. Queste misure sono poco precise e risentono della sensibilità dell'operatore nei riguardi dei colori.
|
 Nel 1909, il chimico e biochimico danese Søren Peter Lauritz Sørensen (1868-1939) propose l'utilizzo di una funzione logaritmica per semplificare l'espressione numerica delle condizioni di acidità o di basicità di una soluzione e, soprattutto, per ben riportare in grafico i risultati delle sue ricerche ([H3O+] poteva variare di parecchi ordini di grandezza):
Nel 1909, il chimico e biochimico danese Søren Peter Lauritz Sørensen (1868-1939) propose l'utilizzo di una funzione logaritmica per semplificare l'espressione numerica delle condizioni di acidità o di basicità di una soluzione e, soprattutto, per ben riportare in grafico i risultati delle sue ricerche ([H3O+] poteva variare di parecchi ordini di grandezza): 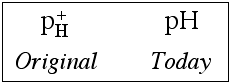 A dire il vero, l'autore, nelle sue pagine originali, usò una strana terminologia
con una p minuscola e una H maiuscoletto a pedice soprasegnata con un segno "+" in alto . La moderna notazione "pH" venne adottata per la prima volta nel 1920 dall'elettrochimico W.M.Clark e successivamente
caldamente raccomandata alla comunità scientifica.
Il "p" minuscolo
oggi è adottato come operatore e sta ad indicare che alla entità che
segue si applica l'operazione di logaritmo decimale cambiato di segno:
A dire il vero, l'autore, nelle sue pagine originali, usò una strana terminologia
con una p minuscola e una H maiuscoletto a pedice soprasegnata con un segno "+" in alto . La moderna notazione "pH" venne adottata per la prima volta nel 1920 dall'elettrochimico W.M.Clark e successivamente
caldamente raccomandata alla comunità scientifica.
Il "p" minuscolo
oggi è adottato come operatore e sta ad indicare che alla entità che
segue si applica l'operazione di logaritmo decimale cambiato di segno:

 Esistono
degli strumenti che misurano il pH basandosi su metodi elettrochimici e vengono
chiamati
"Piaccametri". Si tratta di apparecchiature aventi una parte elettronica
oggigiorno considerata molto semplice e una parte meccanica molto delicata (gli
elettrodi di misura). Questi strumenti necessitano di una opportuna taratura
prima di essere utilizzati e misurano correttamente l'attività protonica.
Sono generalmente corredati da diversi tipi di elettrodi (spesso acquistabili
separatamente), ciascun dei quali risulta idoneo e preciso per determinate applicazioni
ed entro certi range di pH come dichiarato dalle specifiche fornite da
costruttore stesso.
Esistono
degli strumenti che misurano il pH basandosi su metodi elettrochimici e vengono
chiamati
"Piaccametri". Si tratta di apparecchiature aventi una parte elettronica
oggigiorno considerata molto semplice e una parte meccanica molto delicata (gli
elettrodi di misura). Questi strumenti necessitano di una opportuna taratura
prima di essere utilizzati e misurano correttamente l'attività protonica.
Sono generalmente corredati da diversi tipi di elettrodi (spesso acquistabili
separatamente), ciascun dei quali risulta idoneo e preciso per determinate applicazioni
ed entro certi range di pH come dichiarato dalle specifiche fornite da
costruttore stesso.