Legami covalenti polari e non polari
Si definisce qualitativamente l'elettronegatività come "la tendenza di un atomo ad attrarre maggiormente su di se la carica elettronica di legame".
 |
|
Elettronegatività secondo Linus Carl Pauling
La asimmetria nella distribuzione della carica elettrica genera la presenza di una percentuale di carattere ionico nel legame che contribuisce a renderlo più stabile.
L'elettronegatività di un elemento non è una grandezza misurabile direttamente. Esistono comunque vari metodi per definirla quantitativamente. Robert Mulliken, propose di calcolarla come media aritmetica tra il potenziale di ionizzazione e l'affinità per l'elettrone.
Valori abbastanza sommabili e proporzionali a quelli ottenuti da Mulliken, si ottengono con il criterio suggerito da Pauling e trattato qui di seguito.
Si consideri una semplice molecola biatomica AB costituita da due atomi diversi e con diversa elettronegatività. Indichiamo con EABsper l'energia di legame ottenuta sperimentalmente per la specie AB e con EABteor l'energia di legame teorica calcolata come media delle energie di legame sperimentali delle molecole omonucleari AA e BB. Il valore teorico così determinato presuppone che il legame AB sia covalente apolare. Praticamente in tutti i casi si osserva che l'energia sperimentale risulta maggiore del valore calcolato teoricamente perché quest'ultimo non comprende il contributo di carattere ionico. In sintesi:
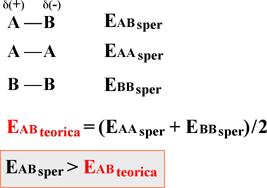
La differenza tra l'energia di
dissociazione sperimentale e quella teorica calcolata con il
criterio illustrato è da imputare al carattere polare
della molecola.
Indichiamo con ![]() tale differenza
tale differenza
Secondo Pauling, la radice quadrata della suddetta differenza è rappresentativa della differenza di elettronegatività tra i due elementi e consente di stabilire una scala sommabile di valori di elettronegatività
Con la formula precedente è possibile calcolare
solo differenze di elettronegatività.
Fissando arbitrariamente, ad esempio, il valore 2.2 per
l'idrogeno, si possono ottenere facilmente tutti gli altri
valori.
Nota: a) l'uso della radice di
![]() è arbitrario, ma necessario per ottenere valori
facilmente sommabili. b) Le energie sono espresse tutte in
eV: la presenza di coefficienti particolari che trovate in
alcuni libri (0.21) serve come fattore di conversione da
elettroniVolt a Joule o kilocalorie o altre unità di
misura dell'energia.
è arbitrario, ma necessario per ottenere valori
facilmente sommabili. b) Le energie sono espresse tutte in
eV: la presenza di coefficienti particolari che trovate in
alcuni libri (0.21) serve come fattore di conversione da
elettroniVolt a Joule o kilocalorie o altre unità di
misura dell'energia.
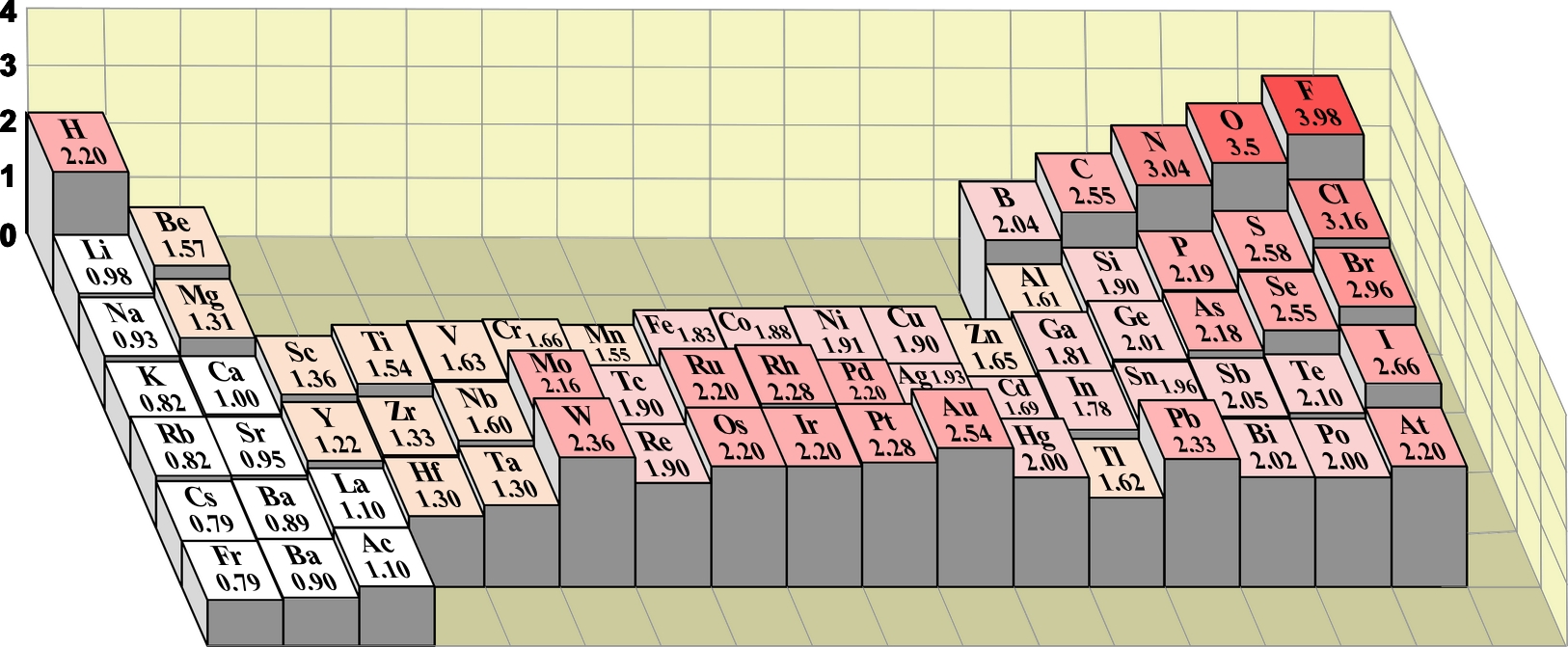
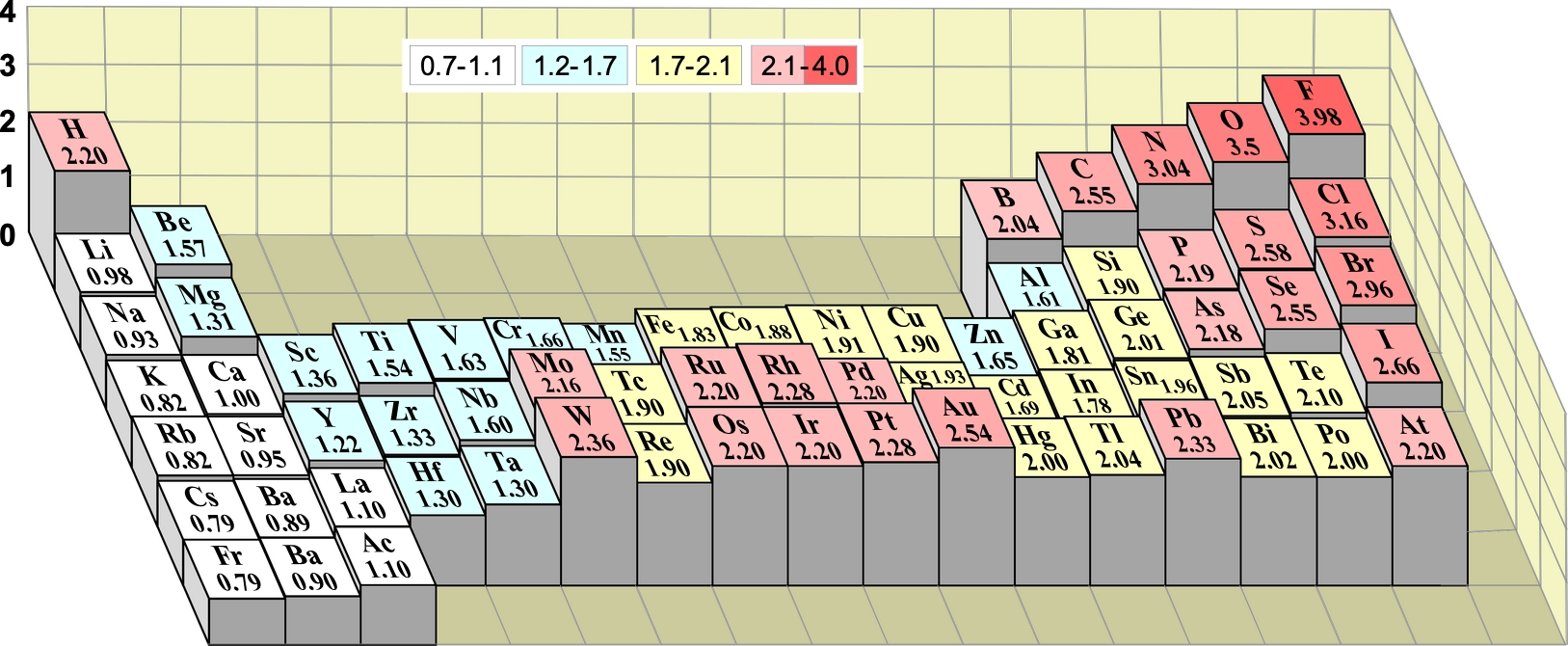
Nella tabella seguente sono indicate le
elettronegatività degli elementi secondo Pauling, con valori revisionati utilizzando dati di energie di legame più moderni; l'intensità del colore dello sfondo è funzione del valore di elettronegatività.
Tranne eccezioni negli elementi di transizione (nei gruppi dal 6 al 12) e nei gruppi 13 e 14, la proprietà "tende" ad aumentare spostandosi verso destra lungo il periodo e verso l'alto nel gruppo convergendo verso il valore massimo assunto dal fluoro. Alcuni autori per evitare di evidenziare il gran numero di eccezioni scrivono all'incirca: "per gli elementi rappresentativi, solitamente, l'elettronegatività aumenta da sinistra verso destra e aumenta dal basso verso l'alto nei gruppi".
Si
noti che l'idrogeno, dal punto di vista dell'elettronegatività, si può considerare compreso tra
gli elementi del tredicesimo e quattordicesimo gruppo con numero quantico principale 2.
Su Wikipedia trovate una tabella di elettronegativitą bidimensionale che nello sfondo usa un contrasto tra due colori che rende pił evidenti le eccezioni che ho indicato (tab.elettr.ITA; tab.elettr.EN).
| H 2.20 |
|||||||||||||||||
| Li 0.98 |
Be 1.57 |
B 2.04 |
C 2.55 |
N 3.04 |
O 3.44 |
F 3.98 |
|||||||||||
| Na 0.93 |
Mg 1.31 |
Al 1.61 |
Si 1.90 |
P 2.19 |
S 2.58 |
Cl 3.16 |
|||||||||||
| K 0.82 |
Ca 1.00 |
Sc 1.36 |
Ti 1.54 |
V 1.63 |
Cr 1.66 |
Mn 1.55 |
Fe 1.83 |
Co 1.88 |
Ni 1.91 |
Cu 1.90 |
Zn 1.65 |
Ga 1.81 |
Ge 2.01 |
As 2.18 |
Se 2.55 |
Br 2.96 |
|
| Rb 0.82 |
Sr 0.95 |
Y 1.22 |
Zr 1.33 |
Nb 1.60 |
Mo 2.16 |
Te 1.90 |
Ru 2.20 |
Rh 2.28 |
Pd 2.20 |
Ag 1.93 |
Cd 1.69 |
In 1.78 |
Sn 1.96 |
Sb 2.05 |
Te 2.10 |
I 2.66 |
|
| Cs 0.79 |
Ba 0.89 |
La 1.10 |
Hf 1.30 |
Ta 1.50 |
W 2.36 |
Re 1.90 |
Os 2.20 |
Ir 2.20 |
Pt 2.28 |
Au 2.54 |
Hg 2.00 |
Tl 1.62 |
Pb 2.33 |
Bi 2.02 |
Po 2.00 |
At 2.20 |
|
Nella figura seguente viene illustrata la percedente tabella ma in visione altimetrica tridimensionale.
Segue ancora lo stesso modello di tabella, ma in essa viene eliminate la gradualità della colorazione per meglio individuare gli elementi con minore e maggiore elettronegatività. In rosso gli elementi con elettronegatività comprese tra 2.1 e 4, in giallo quelli con elettronegatività compresa tra 1.7 e 2.1, in azzurro e bianco gli elementi via via meno elettronegativi.
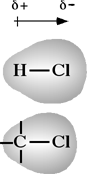
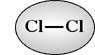 Quando il legame covalente si forma tra due atomi uguali (es. a destra), oppure fra due atomi diversi che presentano praticamente la stessa elettronegatività, gli elettroni, con la relativa carica, sono equamente condivisi e il legame si definisce non polare. Se invece i due atomi diversi hanno differente elettronegatività (vedi esempi a sinistra), gli elettroni risultano localizzati mediamente più vicino all'atomo più elettronegativo. Come conseguenza della iniqua distribuzione di carica, il legame risulterà polare, dando luogo ad un dipolo elettrico permanente, ed il legame è da intendersi come legame covalente polare.
Quando il legame covalente si forma tra due atomi uguali (es. a destra), oppure fra due atomi diversi che presentano praticamente la stessa elettronegatività, gli elettroni, con la relativa carica, sono equamente condivisi e il legame si definisce non polare. Se invece i due atomi diversi hanno differente elettronegatività (vedi esempi a sinistra), gli elettroni risultano localizzati mediamente più vicino all'atomo più elettronegativo. Come conseguenza della iniqua distribuzione di carica, il legame risulterà polare, dando luogo ad un dipolo elettrico permanente, ed il legame è da intendersi come legame covalente polare.