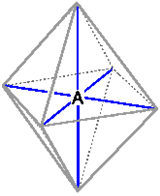
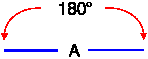Geometria molecolare
Affermare che la covalenza (il numero
di legami che un atomo può fare) coincide con
il numero di elettroni spaiati e disponibili ad accoppiarsi,
può essere un buon punto di partenza per scrivere una
formula chimica, ma rimane ancora oscura la geometria che assume la
molecola. La disposizione spaziale degli atomi nelle
molecole può essere prevista mediante il metodo introduttivo detto VSEPR originariamente proposto nel 1939 da Ryutaro Tsuchida e raffinato dal Gillespie nel 1957 e ulteriormente rivisto nel 1992 dallo stesso Gillespie (VSEPD: Valence Shell Electron Pair Domain *). Una giustificazione più concreta della
geometria molecolare, che rispetti la teoria del legame di valenza (VB), può
essere ottenuta prendendo in considerazione una conveniente modifica della struttura elettronica di base
degli atomi fra cui si estrinseca il legame: cioè
mediante opportuna combinazione lineare degli orbitali
atomici che possiedono carica elettronica. Questo concetto
fu suggerito, nel 1931 da Linus Pauling e venne chiamato
ibridazione o ibridizzazione.
* "Il modello VSEPR e la sua evoluzione" - CnS, Gennaio-Febbraio 1999, pag. 8-12
M.CHASTRETTE, M.B.LARROUY, K. BOURAOUI - LIRDHIST, Université Claude Bernard -Lyon
* "The VSEPR Model Revisited"; RJ Gillespie - Chemical Society Reviews, 1992 - pubs.rsc.org
Ibridizzazione - Concetti
Con il termine "ibridizzazione" si intende una procedura matematica attraverso la quale orbitali atomici di tipo diverso (indichiamoli come orbitali atomici semplici o puri) ma con contenuto di
energia dello stesso ordine di grandezza, formano un ugual
numero di nuovi orbitali detti "ibridi" che sono
isoenergetici e di uguale forma.
Gli orbitali ibridi sono matematicamente descritti da
combinazioni lineari delle equazioni d'onda orbitali di partenza e, come recita un teorema delle equazioni differenziali, sono ancora delle soluzioni dell'equazione di Schrödinger. Le funzioni d'onda "ibride" possono essere
rappresentate, in termini di densità di probabilità, da forme orbitaliche che presentano,
rispetto alle forme orbitaliche semplici di partenza, una maggiore concentrazione delle densità di probabilità
elettroniche in ben definite direzioni dello spazio che
costituiscono le direzioni di legame. La maggiore localizzazione direzionale consente maggiori ricoperture e gli
orbitali ibridi formano, quindi, legami più forti
che non gli orbitali semplici da cui provengono.
Si possono ibridizzare orbitali occupati da almeno un elettrone e la procedura non richiede
necessariamente promozione di elettroni se non è necessario.
A seconda del numero e del tipo degli orbitali "puri"
di provenienza, gli orbitali ibridi risultanti danno luogo a forme orbitaliche ibride che presentano
disposizioni geometriche differenti come ora andremo a verificare.
Nota: nelle figure che segueno, tra parentesi quadre rosse ho messo le rappresentazioni semplificate delle forme orbitaliche ibride, volutamente più allungate per evidenziarne meglio la direzione.
|
IBRIDAZIONE sp (lineare) |
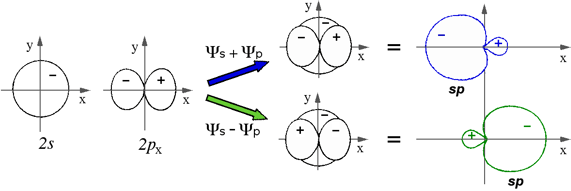
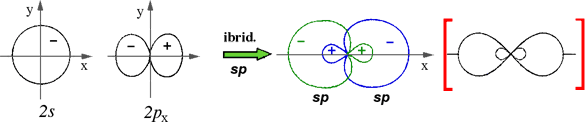
Esempi proposti in aula (BeH2, BeCl2, .. C2H2)
|
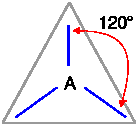
IBRIDAZIONE sp2 (trigonale) |
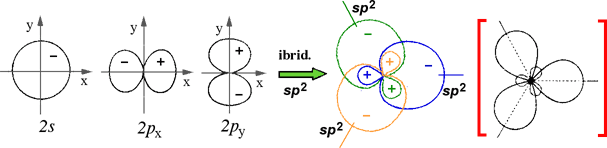
Esempi proposti in aula (BH3, ... C2H4)
|
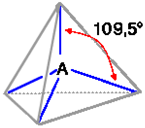
IBRIDAZIONE sp3 (tetraedrica) |
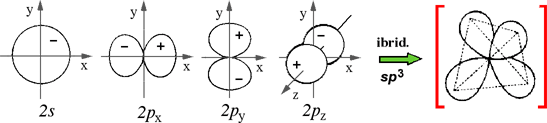
Esempi proposti in aula (CH4, NH3, H2O)
|
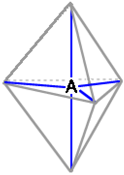
IBRIDAZIONE sp3d ed sp3d2 (bipiramide trigonale e ottaetrica) |
Di questi due tipi di ibridazioni, che giustificano la cosiddetta
"espansione dell'ottetto", diamo la geometria molecolare nella tabella che segue. Diciamo solo che si tratta di doppie ibridazioni (sp3d = sp2+pd; sp3d2=sp2+pd2); come conseguenza gli orbitali, le rispettive forme orbitaliche, e anche i legami risultanti, non sono tutti equivalenti.
Esempi proposti in aula (PCl5,
SF6)
Le più comuni geometrie molecolari
La tabella seguente riassume il numero di posizioni direzionali per gli elettroni di legame in base al tipo di ibridizzazione, la loro possibile disposizione geometrica (che determina la geometria molecolare) e propone alcuni esempi (che verranno chiariti in seguito).
Vedi anche la tabella interattiva:
JSmol view
|
||||||||||||||||||||||||||||||||||||||||||||||||