Legame Covalente
Teoria a coppia di elettroni (Gilbert
Lewis, 1916):
Il
legame covalente tra due atomi è dovuto alla
condivisione di una o più coppie di elettroni
(dette coppie elettroniche di legame) per soddisfare la
tendenza degli atomi stessi a raggiungere la configurazione
elettronica stabile di gas nobile.
Le coppie elettroniche di legame si formano per l'accoppiamento di elettroni che si trovano spaiati quando sono nei rispettivi atomi isolati.
Il numero di legami che un atomo tende a formare (considerato anche con il termine di valenza o covalenza per differenziarla dalla valenza ionica) dipende dal numero di elettroni spaiati che esso possiede. Ho utilizzato il termine "tende" perchè, come vedremo, le cose sono leggermente più complesse. Rifacendosi alle configurazioni elettroniche di alcuni elementi gassosi, si possono evidenziare, secondo Lewis, le seguenti formulazioni per le loro molecole
| elemento (simbolo) | configurazione elettronica |
configurazione esterna |
formazione del legame (molecola) |
| Idrogeno (H) | 1s1 | |
|
| Cloro (Cl) | 1s22s22p63s23p5 | |
|
| Ossigeno (O) | 1s22s22p4 | |
|
| Azoto (N) | 1s22s22p3 | |
|
| Neon (Ne) | 1s22s22p6 | |
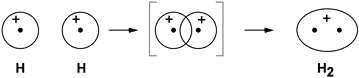
Cosi, ad esempio, la formazione della molecola
dell'idrogeno H2 è dovuta al
singolo legame covalente, ottenuto dalla messa in comune
degli unici elettroni spaiati posseduti dai due atomi che
costituiscono la molecola. I legami chimici covalenti, e genericamente
anche una coppia di elettroni, vengono rappresentati mediante un
trattino. In particolare, con lo scopo di evidenziarle, ho
rappresentato le coppie di elettroni di legame con il colore
rosso.
Lo stesso principio vale per la molecola del cloro
Cl2, anch'essa biatomica e, per estensione, agli
altri elementi alogeni F2, Br2,
I2.
Dal punto di vista energetico, la formazione del legame
covalente, con riferimento specifico alla molecola
dell'idrogeno, può essere rappresentata dal seguente
profilo caratterizzato dal minimo intorno alla distanza di legame:
Click sull'immagine per animazione controllata |
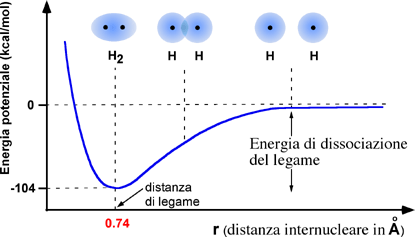 |
Il risultato, alla distanza di legame, è la formazione di un orbitale unico che comprende i due nuclei con spin antiparalleli nel rispetto del principio del Pauli. Gli elettroni adesso appartengono ad entrambi gli atomi in una sorta di rapido scambio. La densità elettronica del sistema risulta più elevata nello spazio tra i due nuclei fungendo da zona legante per i due nuclei.
Nel caso della molecola del cloro la sovrapposizione avviene tra un orbitale "3p" non saturo di un atomo con quello di un altro atomo di cloro. Anche in questo caso si può osservare una maggiore densità elettronica nella zona tra i due nuclei
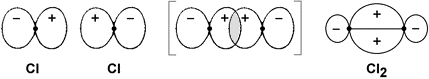
La sovrapposizione tra due orbitali può aver luogo se si trovano in fase (le funzioni d'onda di origine devono avere lo stesso segno) e nel rispetto di opportune simmetrie. Per il momento indichiamo con il termine legame tipo σ come quel legame in cui la sovrapposizione degli orbitali ha lungo la congiungente i due nuclei e con il termine legame di tipo π quando la zona di sovrapposizione si trova esternamente all'asse. In seguito, parlando di orbitali molecolari useremo termini più corretti e coerenti con i concetti di simmetria.
La molecola dell'ossigeno O2, secondo Lewis, possiede due legami covalenti (doppio legame), in virtù della presenza di due elettroni "2p" spaiati nella configurazione esterna dell'atomo di ossigeno. Un legame è dovuto alla sovrapposizione sigma σ (frontale) come nel caso del cloro, l'altro legame si forma per sovrapposizione dei rimanenti orbitali "2p" con un solo elettrone e giacenti su un piano perpendicolare: pertanto il legame risultante dovrà essere di tipo π :
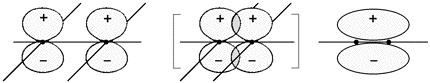
La molecola dell'azoto N2, deve essere costituita in modo tale da possedere un triplo legame, visto che nell'atomo di azoto ci sono tre "2p" elettroni spaiati.
Nei libri di testo sono evidenziate contemporaneamente le sovrapposizioni multiple degli orbitali nel caso delle molecole di ossigeno e azoto.
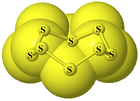
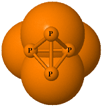
Soffermiamoci un momento sugli elementi che, nella tabella periodica, stanno immediatamente sotto l'ossigeno e l'azoto. Pur avendo la stessa configurazione elettronica esterna, denotano un comportamento diverso a causa della maggiore dimensione atomica. Lo zolfo e il fosforo si presentano come solidi a temperatura ambiente, preferiscono formare legami semplici con se stessi piuttosto che doppi o tripli rispettivamente, dando luogo a molecole ottatomiche e tetratomiche.
 |
 |
|
L'anello ottatomico dello zolfo
|
La molecola tetraedrica del fosforo
|
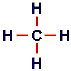
Nella tabella che segue sono considerati, a titolo di esempio, alcuni composti (legami tra atomi di natura diversa). Si osservi il carbonio: per poter formare quattro legami necessita di 4 elettroni spaiati. Per raggiungere questa configurazione, un elettrone "2s" viene promosso su un orbitale "2p" vuoto.
| elemento (composto) |
configurazione elettronica* |
configurazione esterna |
formazione del legame (molecola) |
| Carbonio (metano) |
1s22s12p3 | |
 |
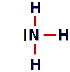
| Azoto (ammoniaca) |
1s22s22p3 | |
 |
| Ossigeno (acqua) |
1s22s22p4 | |
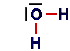 |
| Fluoro (acido fluoridrico) |
1s22s22p5 | |
Zolfo e fosforo ci permettono di evidenziare l'espansione dell'ottetto, dichiarato come struttura stabile dei gas nobili. Il superamento della regola dell'ottetto è spiegabile, nel modello atomico proposto, dalla presenza degli orbitali "d" nel livello energetico esterno del fosforo e dello zolfo, ed è dovuto alla possibilità di promozione di elettroni da orbitali "3s" o "3p" verso gli orbitali "3d" dello stesso livello energetico (ad esempio: PCl5, SF4, SF6).
Nella tabella seguente vengono mostrate le molecole illustrate in classe. Provate a ricostruirle considerando semplicemente la struttura elettronica di base ed eccitata degli atomi centrali posti nella prima colonna, in modo da giustificarne la valenza. In seguito, le stesse molecole, verranno trattate in modo più accurato per giustificare la geometria.
| Elemento | regola ottetto |
ottetto espanso |
|
| Carbonio | CH4, CF4 | ||
| Silicio | SiF4 | ||
| Azoto | NF3 | ||
| Fosforo | PF3, PCl3 | PF5, PCl5 | |
| Ossigeno | OF2 | ||
| Zolfo | SF2 | SF4 | SF6 |