Note di termodinamica CHIMICA (2)
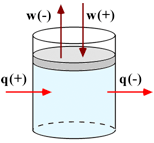
Convenzioni sui segni di lavoro e calore |
 |
IL PRIMO PRINCIPIO e la termochimica
E' in pratica il principio della conservazione dell'energia: secondo tale principio quando, in un processo termodinamico, una certa quantità di energia di un determinato tipo scompare, deve comparire una equivalente quantità di energia di altro tipo. Quindi l'energia può essere trasformata da una tipologia all'altra, ma non può essere creata dal nulla, né distrutta.
Il contenuto energetico di un sistema chimico-fisico è la somma dell'energia rotazionale, traslazionale, vibrazionale delle molecole, più quella degli elettroni e del nucleo. Il valore assoluto dell'energia interna di un sistema non ci è noto e di conseguenza non ci sono noti i valori assoluti di tutte le funzioni derivate.
Se si considera un sistema isolato (nessuno scambio di energia con l'esterno), la sua energia totale rimarrà costante (ΔU=0) anche se, al suo interno, si possono verificare delle trasformazioni di energia da una forma ad un'altra.
Un sistema chimico reale non è quasi mai isolato, e se il sistema è di tipo biologico sarà in pratica aperto e polifasico. Se viene sottoposto ad una trasformazione termodinamica che lo conduce dallo stato A allo stato B, può guadagnare o perdere energia, ma il guadagno o la perdita deve essere compensata rispettivamente da una perdita o da un guadagno di energia, dello stesso tipo o di tipo diverso, da parte dell'ambiente circostante.
In definitiva, la variazione energetica che presenta un sistema, che sia in aumento o in diminuzione, è la somma algebrica dei singoli flussi energetici che si verificano a suo carico. Questi flussi possono essere dovuti a travasi di calore (verso l'ambiente o verso il sistema) oppure a lavoro subito o sviluppato dal sistema oppure, infine, a flussi di materia dal sistema verso l'ambiente o viceversa:
| aperto | ΔU = q + w + ΔUmoli | 2.1 |
L'espressione viene spesso semplificata considerando un sistema chiuso che può scambiare solo energia sotto forma di calore o lavoro. Si evita, in un primo approccio, di considerare l'energia che compete ai flussi di materia, il primo principio si può formalizzare nel modo seguente:
| chiuso | ΔU = q + w | 2.2 |
o, in termini differenziali:
| dU = δq + δw | 2.4 |
L'utilizzo del simbolo di differenziale con il "delta" usualmente serve ad evidenziare che lavoro e calore non sono funzioni di stato. Per tentare di far capire che lavoro e calore non sono funzioni di stato, ma che dipendono dal cammino (o metodo) utilizzato per passare dallo stato iniziale allo stato finale, discuterò un esempio descritto da altri autori che presenta il pregio di non utilizzare le tipiche formulazioni matematiche che in genere propongono fisici e chimico-fisici.
Calore e Lavoro non sono funzioni di stato
Consideriamo il sistema costituito dal comburente ottano (un composto liquido costituente della benzina). L'ottano, come tutti gli idrocarburi, reagisce con l'ossigeno formando diossido di carbonio e acqua. Vi ricordo che al momento della combustione l'acqua si presenta sotto forma aeriforme,
poi cedendo calore all'ambiente (che si trova a circa 25°C) ritorna liquida.
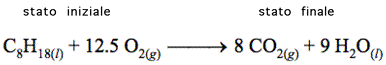
Seguiamo due strade diverse per condurre il sistema dallo stato iniziale a quello finale:
1) Semplice combustione in presenza di ossigeno;
2) Combustione controllata in un motore a scoppio (autoveicoli, gruppi elettrogeni etc.).
Nel primo processo si procede bruciando completamente il composto. In queste condizioni si ottiene semplicemente del calore che il sistema trasferisce all'ambiente, pari a circa 5100 kJ per mole. La variazione di energia interna del sistema, in diminuzione, sarà pertanto ΔU = -5100kJ/mole (attenzione al segno).
Nel secondo processo, anche se la reazione si fa avvenire internamente ad un cilindro, il risultato, in termini chimici, è il medesimo.
Supponendo uguali gli stati iniziali (T, P, moli di ottano) e quelli finali (T, P, CO2, H2O) dei due processi, si deve constatare che nel secondo processo l'energia che si ottiene dal sistema è divisa tra calore e lavoro. Se poi si ottimizzano i metodi di combustione (si pensi ai miglioramenti ottenuti nei moderni motori gestiti da centraline elettroniche) si riesce ad ottenere un aumento del rendimento del motore a favore del lavoro a scapito del calore prodotto. Pertanto, nonostante il sistema chimico si muove dagli stessi reagenti agli stessi prodotti e pur essendo sempre la stessa l'energia spremuta dal sistema, può essere diversa la quantità relativa di energia distribuita tra calore e lavoro. In ogni caso, se aumenta il lavoro diminuirà il calore in maniera tale che
la quantità totale di energia ceduta dal sistema (la somma) rimarrà costante in ossequio al primo principio.
Esistono particolari processi termodinamici nei quali il calore o il lavoro si "comportano" come funzioni di stato e dipendono solo dagli stati iniziali e finali del sistema, ma noi non ci soffermeremo sull'argomento.
Le reazioni chimiche che cedono energia all'ambiente, se lasciate a se stesse producono spesso solo del calore e, bene che vada, dell'energia luminosa. L'ingegno umano ha capito come utilizzarle per ottenere altri tipi di energia. Così come viene fatto nei motori a scoppio, alcune reazioni, con gli opportuni accorgimenti, possono produrre energia elettrica; altre ancora l'insieme congiunto di energia elettrica e chimica (es. negli organismi viventi). La termodinamica, come vedremo, è in grado di predire se un evento reattivo è possibile o meno ma non ha i mezzi per prendere in considerazione gli effetti della variabile “tempo”; non dice nulla sul tempo necessario affinché il processo stesso si verifichi, solo l’esperimento permette di valutarne l'effettiva fattibilità. Ad esempio, la termodinamica permette di predire che la reazione tra il glucosio e l'ossigeno può produrre una grande quantità di energia, ma non dice che la semplice miscela dei due composti è stabile indefinitamente se non si ricorre ad accensione o, nel caso di reazione in soluzione, all'intervento di particolari catalizzatori (enzimi) che accelerano il processo.
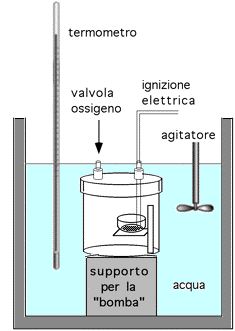 Gli esseri viventi "bruciano" sostanze organiche con modalità piuttosto complesse e producono lavoro, calore ed energia chimica con una resa molto elevata nel prodotto che interessa. L'energia che in ogni modo può essere prelevata dagli alimenti, può essere valutata dal calore ottenuto bruciando completamente, in uno speciale contenitore (bomba calorimetrica), in presenza di ossigeno sotto pressione, una ben nota quantità di alimento contenuta in un crogiolino. Il calore prodotto è rilevato mediante l'innalzamento della temperatura dell’acqua contenuta nel calorimetro.
Gli esseri viventi "bruciano" sostanze organiche con modalità piuttosto complesse e producono lavoro, calore ed energia chimica con una resa molto elevata nel prodotto che interessa. L'energia che in ogni modo può essere prelevata dagli alimenti, può essere valutata dal calore ottenuto bruciando completamente, in uno speciale contenitore (bomba calorimetrica), in presenza di ossigeno sotto pressione, una ben nota quantità di alimento contenuta in un crogiolino. Il calore prodotto è rilevato mediante l'innalzamento della temperatura dell’acqua contenuta nel calorimetro.
Nella tabella seguente sono indicati i calori di combustione (espressi in kcal e kJoule per grammo) delle grandi classi di alimenti generici, nel calorimetro e nell'organismo umano. Le forchette dipendono dagli specifici alimenti all'interno delle classi e le differenze che si riscontrano tra i valori ottenuti nella bomba calorimetrica e l'organismo umano dipendono dalla digeribilità e dall'assorbimento effettivo degli alimenti.
ALIMENTO |
Calore di combustione (calorimetro), kcal/g |
Calore di combustione (organismo) , kcal/g |
Calore di combustione (organismo) , kJoule/g |
| Protidi | 5.5 - 5.8 |
4.2 |
17.5 |
| Lipidi | 9.2 - 9.5 |
7.5 - 9.5 |
30 - 40 |
| Glucidi | 3.7 - 4.2 |
4.1 |
17 |
| Etanolo | 7 |
7 |
29 |
La funzione di stato ENTALPIA
Molti processi avvengono a pressione costante; si pensi ai numerosissimi processi biologici che si verificano alla pressione quasi costante di una atmosfera. Una funzione di stato molto comoda, specie se si lavora a pressione costante è l'ENTALPIA.
L'ENTALPIA è definita a partire dall'energia interna cui si aggiunge il prodotto PV. Così come non è noto il valore assoluto dell'energia interna di un sistema, non lo è neppure il valore assoluto della sua entalpia.
| H = U + PV | 2.5 |
Uno dei motivi dell'introduzione di questa funzione è da attribuire al fatto che il calore scambiato da un sistema a pressione costante, quantità facilmente misurabile, risulta, come è dimostrabile, uguale alla variazione di entalpia del sistema stesso:
| ΔH = H2 - H1 = qp | 2.6 |
La dimostrazione della relazione (2.6) ve la risparmio.
Consideriamo adesso una reazione chimica condotta a pressione costante; per essa il calore di reazione risulta uguale alla variazione di entalpia, che in questo caso è ugule alla differenza tra l'entalpia posseduta dai prodotti e quella posseduta dalla quantità di reagenti necessari ad ottenere quelle quantità di prodotti.
| ΔHreazione = Hprodotti - Hreagenti = qp | 2.7 |
In una reazione, se non si stabilisce esattamente il numero di moli di prodotto ottenute, si fa riferimento alle moli derivanti dai coefficienti stechiometrici. Ma come si può calcolare la variazione di entalpia in un processo chimico se non si può conoscere il valore assoluto di tale grandezza per ogni singolo reagente e prodotto?
La risposta a questa domanda è semplice se si considera che in una reazione chimica gli stessi atomi presenti tra i reagenti sono presenti inalterati nei prodotti, e che pertanto, in una qualunque reazione chimica, l'unica differenza di contenuto energetico riguarda l'energia dei nuovi legami rispetto a quella dei legami vecchi. In pratica si utilizza l'entalpia della reazione di formazione di una mole di composto come se fosse la sua entalpia assoluta.
| ΔH°reazione di formazione = ΔH°f = H°composto | 2.8 |
Vi ricordo che la reazione di formazione riguarda la formazione di un composto a partire dai suoi elementi costituenti. Di norma ci si riferisce alle condizioni standard con T=25°C e P=1atm; i calori standard di formazione di moltissimi composti, sono stati determinati direttamente o indirettamente e opportunamente tabulati.
| Tabella: alcuni valori di entalpia standard di formazione |
| Reazione di formazione | ΔH°f (kJoule mol-1) |
| C(grafite) + 1/2 O2(g) = CO(g) | -110.5 |
| C(grafite) + O2(g) = CO2(g) | -393.5 |
| H2(g) + 1/2 O2(g) = H2O(l) | -285.8 |
| H2(g) + 1/2 O2(g) = H2O(g) | -241.8 |
| 1/2 N2(g) + 3/2 H2(g) = NH3(g) | -45.9 |
| Ca(s) + 1/2 O2(g) = CaO(s) | -635.1 |
Per convenzione (e anche perchè non serve per effetto della semplificazione), l'entalpia di formazione degli elementi vale zero. Utilizzando i valori tabulati è possibile prevedere il ΔH° di una reazione prima ancora di verificarlo sperimentalmente. A titolo di esempio, dai valori dell'entalpia standard di formazione estratti da un handbook, calcoliamo, in kJ/mole, il ΔH° della reazione combustione del normal-ottano:
| C (grafite) + O2 (gas) |
ΔH° = -393.5 | (H°CO2 ) |
| H2 (gas) + 0.5 O2 (gas) |
ΔH° = -241.8 | (H°H2O ) |
| 8 C (grafite) + 5.5 H2 (gas) |
ΔH° = -208.5 | (H°C8H18 ) |
| C8H18 (l) + 12.5 O2 (g) |
ΔH° = ? |
ΔH°combust. ottano = 8 H°CO2 + 9 H°H2O - H°C8H18 = -3148 + (-2176.2) - ( -208.5) = -5115.7 kJ
DEFINIZIONE DI REAZIONE ESO O ENDOTERMICA
Un sistema reattivo che produce calore donandolo all'ambiente perde energia e viene detto esotermico, mentre una reazione che acquista calore dall'ambiente (evidentemente il sistema si è raffreddato e si trova a temperatura inferiore rispetto all'ambiente) ha un comportamento endotermico. Ricordandoci del criterio egoistico:
| Reazione ESOTERMICA (produce e perde calore) | ΔHsistema < 0 | |
| Reazione ENDOTERMICA (richiede e acquista calore) | ΔHsistema > 0 |
ENTALPIA DI SOLUZIONE
Quando un soluto si scioglie in un solvente si verifica la rottura di legami s-s (soluto-soluto) e la formazione di interazioni s-S (soluto-Solvente). Il processo può essere esotermico o endotermico (nei casi ideali è atermico) e il sistema soluzione pertanto scambia calore con l'ambiente.
Se si suppone, come normalmente accade, di lavorare a pressione costante, tale calore rappresenta l'entalpia di soluzione. Si valuta rilevando il calore assorbito o prodotto durante il fenomeno di solubilizzazione di una mole di soluto in un grande eccesso di solvente.
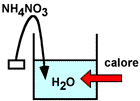
Vediamo due esempi con comportamento opposto:
 |
 |
NH4NO3 (solido) + H2O processo endotermico ΔH°soluz. ≈ + 28 kJ/ mole |
NaOH (solido) + H2O processo esotermico ΔH°soluz. ≈ – 40 kJ/mole |
Il primo processo, di natura endotermica, viene sfruttato nel cosiddetto ghiaccio istantaneo utilizzato nei Kit di pronto soccorso (colpi di calore, contusioni etc.). Si tratta di un contenitore con due scomparti contenenti rispettivamente nitrato di ammonio e acqua; con opportuna pressione si rompe la separazione e la soluzione ottenuta arriva quasi a congelare.
CALORI LATENTI
Durante una trasformazione di fase, il calore ceduto o acquistato dal sistema considerato, viene utilizzato per formare o distruggere le interazioni che determinano la sostanziale differenza tra le due fasi. Se il processo viene condotto lentamente, il calore scambiato si chiama calore latente di transizione di fase. Se si lavora a pressione costante, il calore latente corrisponde alla variazione di entalpia associata alla transizione (es. ΔHfusione, ΔHvaporizz., ΔHcondensazione, ΔHsolidificazione).