Note di termodinamica CHIMICA (1)
La termodinamica studia le trasformazioni dell'energia da una forma all'altra e tende a centralizzare la propria attenzione verso un sistema posto in relazione con l'ambiente circostante.
La termodinamica è in stretta relazione con la bioenergetica (quella parte della biologia che si occupa dello studio quantitativo delle conversioni di energia che avvengono all’interno delle cellule) e con la natura dei processi chimici alla base delle conversioni energetiche.
| SISTEMA: | Porzione di spazio delimitata da una superficie reale o virtuale (ovvero la parte di universo che intendiamoi studiare) |
| AMBIENTE: | Tutto ciò che va oltre il limite del sistema ma che può avere influenza sul suo comportamento |
| UNIVERSO: | Ambiente + Sistema |
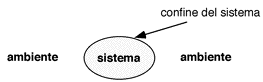
TIPI DI SISTEMA
In base alla relazione con l'ambiente il sistema può essere:
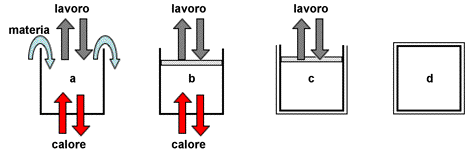
| a) | Aperto - Può scambiare materia ed energia con l'ambiente | |
| n) | Chiuso - Può scambiare solo energia con l'ambiente (lavoro e calore etc.) | |
| c) | Chiuso Adiabatico - Isolato termicamente e pertanto può scambiare solo energia in forme diversa dal calore | |
| d) | Isolato - (isolato totalmente) Non scambia ne materia ne energia con l'ambiente |
Con riferimento alle sue proprietà chimico-fisiche un sistema può essere:
Omogeneo: se le sue proprietà sono costanti in tutta la sua estensione o variano con gradualità (es.
una sostanza chimica semplice gassosa, una miscela di gas, una soluzione non satura, un solido cristallino puro).
Eterogeneo:
quando si possono distinguere in esso due o più parti omogenee, dette "fasi" del sistema, distinte da superfici di separazione a volte evidenti a volte meno.
Ne sono esempi:
una miscela di acqua e ghiaccio (bifasico), un liquido in ebollizione, una soluzione salina satura in presenza dello stesso sale indisciolto allo stato cristallino (bifasico), due liquidi non miscibili (bifasico), una cellula in cui compaiono varie superfice di separazione tra i vari organuli.
Lo stato di un sistema in condizioni di equilibrio è definito dalle sue proprietà che possono essere intensive od estensive:
- Proprietà INTENSIVE - Sono indipendenti dalle dimensioni del sistema (es. temperatura, pressione) o sono riferite all'unità di materiale (Densità [massa/volume], concentrazione [moli/volume]).
- Proprietà ESTENSIVE - Sono dipendenti dall'estensione del sistema (es. Volume, massa, potenziali termodinamici Energia, Entalpia, Energia libera).
FUNZIONI DI STATO
Alcune proprietà del sistema sono funzioni di stato. Significa che dipendono esclusivamente dallo stato in cui si trova il sistema (costituzione chimica, stato fisico di aggregazione, temperatura e pressione),
non importa come si è proceduto per raggiungere lo stato in questione. La conseguenza per nulla irrilevante consiste nel fatto che passando dallo stato (1) allo stato (2), la variazione subita dal valore della funzione di stato risulta la differenza tra il valore assunto nello
stato finale e il valore che possedeva nello stato di partenza, indipendentemente dal percorso utilizzato per ottenere la trasformazione.
| Δ Z = Z2 - Z1 | (1) |
La cosa vi può sembrare logica, ma è altrettanto logica la possibilità di discutere di grandezze che non sono funzioni di stato. Ad esempio, come vedremo, il calore ed il lavoro relativi al sistema, possono assumere valori diversi a seconda delle modalità con cui si effettuano le trasformazioni e non è detto che dipendano dagli stati del sistema.
La termodinamica si basa su dei principi che sono dei dati di fatto mai smentiti. In generale essa studia le variazioni di determinate grandezze e raramente ne fornisce valori assoluti. Prima di enunciare i principi della termodinamica, proviamo a definire alcune funzioni termodinamiche (ometterò il concetto di temperatura, già espresso trattando i gas).
LAVORO
Dal punto di vista meccanico si definisce come lo scalare F·s (forza per spostamento); pertanto può essere ricondotto al caso in cui un corpo viene spostato per azione di una forza. La quantità di lavoro compiuto dalla forza è uguale al prodotto dell’intensità della forza per la componente dello spostamento parallela alla forza stessa.
Il lavoro (indicato con la lettera "w") svolto durante il passaggio dal punto a al punto b sarà pertanto espresso da
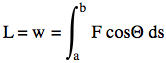
ove F è la forza complessivamente applicata e "teta" è l'angolo compreso tra la direzione di F e la direzione dello spostamento elementare ds. Nel sistema MKS Internazionale il lavoro si esprime in newton*m detto Joule
 |
James Prescott Joule 24 dicembre 1818 - 11 ottobre 1889, nato a Salford Figlio di un ricco birraio di Manchester, fu allievo di John Dalton. |
ENERGIA
L'energia di un sistema è espressione della sua capacità di compiere Lavoro.
In termini diversi si può definire l’energia come l'attitudine di un corpo (o sistema) a compiere lavoro, ovvero quella proprietà di un corpo (o sistema) che può essere convertita in lavoro. E' possibile definire vari tipi di energia a seconda delle condizioni nelle quali il sistema produce il lavoro:
Energia potenziale o di posizione |
Chimica |
| TIPO di Energia Chimica | ESEMPIO |
| di legame | Connessioni tra atomi |
| di livello elettronico | Molecole dopo assorbimento di radiazioni visibili o ultraviolette |
| di livelli vibro-rotazionale | Molecole eccitate termicamente e dopo assorbimento di radiazioni infrarosse o microonde |
| osmotica | Membrane separate da concentrazioni differenti |
| elettrochimica | Elementi capaci di trasferire elettroni |
L'unità di misura dell'energia è la stessa del lavoro; viene indicata con le lettere "E" oppure "U".
CALORE
E' un modo alternativo per scambiare energia, diverso dal Lavoro.
Quando due corpi con differente temperatura sono posti in contatto termico, avverrà un trasferimento di energia, un flusso di calore, da quello a temperatura più elevata verso quello a temperatura più bassa. Ancora oggi si adottano gli stessi metodi di misura elaborati dai sostenitori della teoria del calorico.
Una certa quantità di calore trasferito, trattandosi di energia, può quindi essere espresso in Joule, ma spesso si usa come unità pratica la caloria a 15°C. La caloria è la quantità di calore necessaria, alla pressione di 1 atm, per aumentare la temperatura di un grammo di acqua da 14.5°C a 15.5°C. La caloria, indicata con il simbolo cal, corrisponde a 4.184 Joule. Un suo multiplo molto usato è la kilo-caloria indicata in passato come grande caloria Cal (1 kcal = 1 Cal = 1000 cal).
Riepilogo unità di misura:
| Energia | w | Lavoro: | Newton * metro = Joule (J) |
| q | Calore: | cal (1 cal = 4.18 J) | |
| V | Volume: | metro cubo (m3); 1 cm3 = 1 mL; 1 dm3 = 1 L | |
| P | Pressione: | 1 atm = 101325 Pa = 1.033 Kg/cm2 = 760 mmHg (o torr) | |
| 1 Bar = 100000 Pa = 1000 hPa = 0.987 atm | |||
| 1 mBar = 100 Pa = 1 hPa = 1/1013.25 atm |
PRINCIPIO ZERO DELLA TERMODINAMICA
La temperatura è una proprietà fisica di un sistema che sottolinea la comune nozione di caldo e freddo, interpretando come "maggiore" la temperatura di un corpo più caldo.
Più precisamente la temperatura è una proprietà della materia. Nella scala microscopica la temperatura è definita come la media delle energie distribuite nel movimento delle molecole nei vari gradi di libertà traslazionali, rotazionali e vibrazionali. Nella scala macroscopica la temperatura è l’unica proprietà della materia che stabilisce il flusso di calore tra due oggetti posti a contatto. In queste condizioni il calore fluisce dal corpo a temperatura maggiore verso quello a temperatura minore, fino al raggiungimento dell’equilibrio termico (i due oggetti assumeranno la medesima temperatura). Quello appena espresso è definito come principio zero della termodinamica.