Livelli energetici dell'atomo di idrogeno
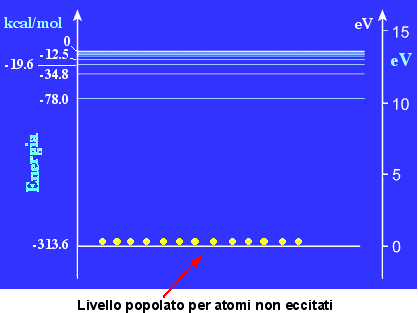
In seguito ad opportuna eccitazione di una numerosa popolazione di atomi, i livelli energetici risulteranno statisticamente tutti popolati. Il ritorno graduale al livello fondamentale, anche mediante ritorni a livelli intermedi eccitati, produce lo spettro a righe caratteristico dell'atomo di idrogeno. Con uno spettroscopio ottico sarà possibile vedere solo le righe derivanti dal ritorno al primo livello energetico eccitato (n=2) perché ricadono nel visibile (serie di Balmer).
Serie Spettroscopiche dell' idrogeno
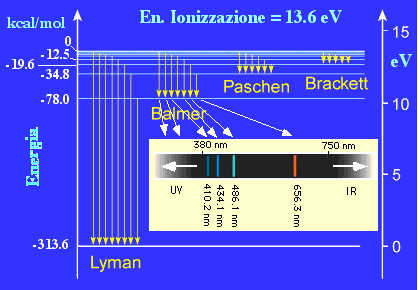
Spettro a righe nella zona visibile per l'idrogeno (serie di Balmer):
NUMERI QUANTICI. Le osservazioni
sperimentali erano quanto mai soddisfacenti. La posizione
delle righe osservate con la strumentazione allora esistente
era perfettamente in accordo con il modello atomico proposto
da Bohr.
Ben presto, con l'affinarsi degli strumenti, con
esperienze condotte su atomi polielettronici e in presenza
di campi magnetici, vennero messi in evidenza i cosiddetti
multipletti nelle righe spettroscopiche ritenute singole.
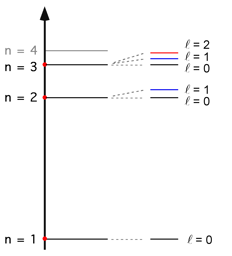 Si rese necessario, pertanto, l'introduzione di ulteriori
numeri quantici (Bohr-Sommerfield) per spiegare l'origine
dei multipletti e adattare il modello atomico alle nuove
realtà sperimentali. I numeri quantici introdotti (l ed m) riconducevano ad orbite ellittiche con diversa eccentricità a seconda del valore di (l) e con diversa orientazione nello spazio a seconda del valore di (m).
Si rese necessario, pertanto, l'introduzione di ulteriori
numeri quantici (Bohr-Sommerfield) per spiegare l'origine
dei multipletti e adattare il modello atomico alle nuove
realtà sperimentali. I numeri quantici introdotti (l ed m) riconducevano ad orbite ellittiche con diversa eccentricità a seconda del valore di (l) e con diversa orientazione nello spazio a seconda del valore di (m).
(l) poteva assumere valori interi da 0 a n-1 mentre (m), detto numero quantico magnetico, poteva assumere valori compresi da -(l) a +(l) zero compreso. Nel disegno sulla sinistra sono evidenziati i sottolivellil energetici relativi al secondo numero quantico (l) per i primi tre livelli principali.
