Note di termodinamica CHIMICA (5)
Standard biochimico
Il ΔGM° fornisce un'idea del grado di avanzamento di una reazione e ne caratterizza il valore della costante di equilibrio. Se però le condizioni in cui ci si ritrova sono molto discoste da quelle standard (Pressione e temperatura standard e attività unitarie per tutti i reagenti e prodotti), l'informazione che immediatamente si ricava potrebbe non essere molto indicativa della realtà.
Consideriamo, ad esempio, le reazioni che avvengono in condizioni di pH tamponato intorno alla neutralità in cui il protone interviene come reagente o come prodotto. L'attività unitaria per la specie H+ significa, con buona approssimazione, che la soluzione deve avere un pH prossimo allo zero. Questa alta acidità è assurda ed oltremodo particolarmente irrealistica per i sistemi biologici che operano, di norma, con valori prossimi a pH=7. Si evince che i valori dei ΔGM° per i sistemi biologici nei quali interviene H+ possono fornire, se non si fanno i calcoli specifici, indicazioni alquanto fuorvianti, come avremo modo di vedere nell'esempio in seguito riportato. Per tali sistemi generalmente si usa un nuovo standard per la differenza di energia libera molare e lo si indica con ΔGM°' (deltaG standard primo). Questo valore è ottenuto considerando la differenza di energia libera molare di Gibbs nelle condizioni standard eccetto che per l'attività dello ione H+. Consideriamo una reazione descritta dal seguente schema generico:
|
A + B |
Per essa sarà:
|
Estraiamo, dal quoziente di reazione, il termine che comprende il protone:
|
In ambiente tamponato si può supporre che (H+) rimane costante e pertanto il termine estratto si può associare con il ΔGM° in un nuovo termine costante che, come già detto, chiameremo ΔGM°'
|
Pertanto, per la razione considerata, sarà lecito scrivere:
| ΔGM°' = ΔGM° + RT ln(H+) |
Il valore di questo nuovo standard è notevolmente diverso rispetto allo standard chimico, ma fornisce indicazioni più vicine ai sistemi che si stanno studiando. La costante di equilibrio correlata al valore di ΔGM°' può essere indicata come K'eq e rammenta le costanti apparenti degli acidi deboli.
Vediamo adesso un esempio di natura biologica. La nicotinammide adenindinucleotide (NAD) è uno dei più importanti trasportatori di elettroni nelle cellule viventi. Esso può esistere nella forma ossidata (NAD+) o ridotta (NADH):
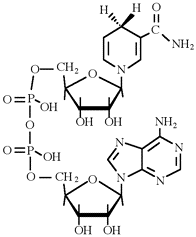 |
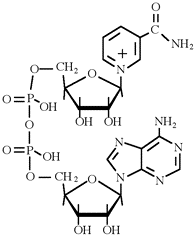 |
NADH |
NAD+ |
Teoricamente il NADH potrebbe essere ossidato secondo la seguente equazione:
| NADH
+ H+ |
ΔGM° = -21.84 kJ/mol |
La reazione considerata è molto esoergonica e, pertanto, a prima vista, molto favorita. Potete immaginare il disastro, se si verificasse massivamente. Andiamo a verificare che cosa succede a pH fisiologico. Per la reazione su indicata si può scrivere:
|
|
|
In condizioni più vicine a quelle fisiologiche, il valore standard della differenza di energia libera risulta sfavorevole alla reazione.
REAZIONI ACCOPPIATE
Supponiamo di studiare la seguente generica reazione di equilibrio che fornisce come prodotti le sostanze X e Y:
| D + F |
5.1 |
Se siamo in condizioni di equilibrio e si aggiunge, nella zona in cui si verifica la reazione, una certa quantità di D, il sistema reagisce alla variazione apportata consumando un poco della sostanza aggiunta D (principio di Le Chatelier) spostando l'equilibrio verso destra. Supponiamo adesso di attivare (mediante un opportuno catalizzatore), e sempre nella stessa zona della reazione, un nuovo processo di equilibrio che abbia come prodotto la sostanza D:
| A + B |
5.2 |
Appena si forma una quantità di D come prodotto della (5.2), il processo (5.1) reagisce tentando di consumarlo. Questo tentativo induce, sempre in applicazione del principio di Le Chatelier, il processo 5.2 a riformare ancora D che sarà ancora parzialmente consumato dal processo (5.1) che .... etc. Si tratta, in linea di massima, di un principio di Le Chatelier a catena, come se contemporaneamente la 5.2 spingesse la 5.1 che provvede a tirare verso destra la 5.2. Si capisce che l'effetto è quello di una sorta di amplificazione che provoca un discreto spostamento dell'equilibrio complessivamente verso destra.
Vi ho fornito una spiegazione intuitiva del fenomeno che riguarda le reazioni accoppiate. E' possibile dimostrare che la variazione di energia libera molare standard del processo complessivo risulta essere la somma di quella relativa ai singoli processi
Definizione
Si parla di reazioni accoppiate quando due reazioni diverse hanno almeno un componente prodotto di una che è anche un componente reagente dell'altra. Affinché l'accoppiamento sia reale, i due processi devono avvenire nella stessa zona dello spazio o nello stesso micro-ambiente.
Trasferimento di gruppi fosfato
Non mi soffermerò a proporvi esempi che studierete in biochimica. Ma ritengo interessante una piccola discussione sul trasferimento di gruppi fosfato.
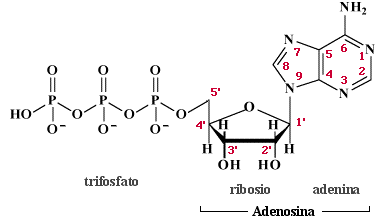 |
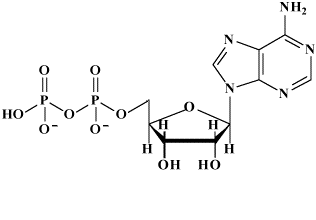 |
ATP 3- |
ADP 2- |
Particolare importanza nel campo della biologia è rivestito dall'accoppiamento possibile tra numerosi tipi di reazioni che idrolizzano trasferendo gruppi fosfato (Pi) necessari come reagenti di un equilibrio successivo che può venire così forzato verso destra. Una delle sostanze che idrolizza fornendo gruppi fosfato è l'ATP (adenosina 5'-trifosfato) che rilascia appunto fosfato inorganico. Nelle condizioni di pH fisiologico l'ATP presenta i due gruppi fosfato interni completamente deprotonati mentre il gruppo terminale risulta totalmente deprotonato per il primo protone e parzialmente per il secondo; in queste stesse condizioni gli anioni fosfato sono presenti sotto forme parzialmente protonate. Ecco come potremmo rappresentare la reazione:
| ATP 3- + H2O |
Se si utilizzano gli standard biologici, la reazione può venire schematizzata molto più semplicemente nel modo seguente:
| ATP + H2O |
ΔGM°'= -30.5 kJ mol-1 |
La reazione di scissione idrolitica dell'ATP è molto esoergonica ed è accompagnata da un aumento di entropia del sistema: indubbiamente la costante di equilibrio del processo è elevata. In realtà una soluzione di ATP rimane sotto questa forma per un lungo periodo di tempo perchè il processo idrolitico è abbastanza lento dal punto di vista cinetico (inerte). Il processo, quando è necessario, deve essere velocizzato mediante dei catalizzatori (ATPasi). Se si aggiunge l'opportuno catalizzatore ad una soluzione di ATP, la reazione procede speditamente e, come risultato, si otterrà un aumento di entropia e lo sviluppo di una certa quantità di calore. La variazione di entalpia costituisce la gran parte dell'energia liberata durante il processo. Se invece il fosfato è un componente intermedio di una reazione accoppiata, l'energia sarà utilizzata per formare il nuovo legame del gruppo fosfato, cioè verrà sfruttata sotto forma di energia chimica spingendo i processi successivi verso destra. Nei termini appena descritti si parla di trasferimento del gruppo fosfato, e l'energia di scissione idrolitica viene chiamata potenziale di trasferimento (si usa con il segno cambiato). Il potenziale di trasferimento del gruppo fosfato da parte dell'ATP dipende, oltre che dal pH, anche da alcuni ioni metallici presenti in soluzione (es. Mg++) con cui i gruppi fosfato possono facilmente interagire.
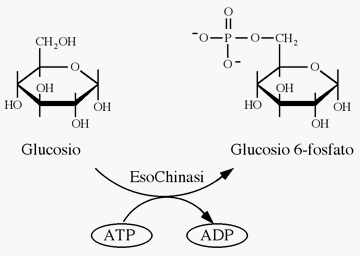
Un esempio in cui l'ATP viene utilizzato per trasferire il gruppo fosfato è la sintesi del glucosio-6-fosfato, la prima tappa nella via dell'utilizzo del glucosio in molti organismi viventi:
| 1) | Glucosio + Pi |
ΔGM1°'= +13.8 kJ mol-1 |
| 2) | ATP + H2O |
ΔGM2°'= -30.5 kJ mol-1 |
| 3) | ATP + Glucosio |
ΔGM3°'= -16.7 kJ mol-1 |
Il processo (1) è abbastanza endoergonico, pertanto piuttosto sfavorito. Se accoppiato al processo (2), come risultato si otterrà un processo totale che risulta essere la somma (3). Il ΔGM3°' complessivo assume un valore negativo, tipico di un processo esoergonico pertanto piuttosto favorito.
L'ATP non è affatto l'unico composto in grado di trasferire gruppi fosfato. Ad esempio il Creatinfosfato ha un potenziale di trasferimento addirittura maggiore (ΔGM°'= -43.0 kJ mol-1).
L'ATP è il principale composto sintetizzato nei mitocondri delle cellule degli animali per "conservare" energia chimica riutilizzabile, alla bisogna, mediante il trasferimento del gruppo fosfato durante la reazione di idrolisi.
Uno dei passaggi della reazione (1) di idrolisi dell'ATP prevede la rottura del legame pirofosforico, ma non si deve addebitare l'energia libera dell'intero processo a questo semplice fatto. Espressioni come "legame pirofosforico ad alta energia" possono essere fuorvianti perchè l'energia libera utilizzabile riguarda la differenza di stabilità tra reagenti e prodotti dell'intera reazione (1) e non un semplice legame.
I concetti termodinamici, ed in particolare il potenziale chimico, vengono utilizzati per risolvere, in maniera ineccepibile e non semplificata, alcuni concetti fondamentali dei sistemi biologici quali quelli inerenti gli equilibri di membrana come la diffusione, la dialisi, gli equilibri di Donnan, le proprietà colligative, la permeabilità selettiva e il potenziale di membrana, il trasporto attivo e la produzione di ATP mediante flussi protonici.
Lo spazio opportuno da dedicare a questi argomenti sfocia nella chimica-fisica, pertanto la nostra trattazione qualitativa termina qui.