Note di termodinamica CHIMICA (4)
Note conclusive sull'entropia e introduzione all'Energia Libera
La variazione di entropia che "globalmente" accompagna un processo ci permette di stabilire se esso tende ad evolvere in un certo senso o in senso inverso, ma non ci permette facilmente di determinarne l'entità dello spostamento rispetto alla situazione di partenza. Una ulteriore difficoltà riguarda la valutazione della variazione dell'entropia dell'ambiente. Si impone l'utilizzo di una funzione ausiliaria che consenta di stabilire la spontaneità di un processo senza la necessità di considerare ciò che accade all’ambiente. Tale funzione esiste e si chiama Energia Libera. La sua validità, riguardo all'uso che ne intendiamo fare, è ristretta a determinate condizioni. Le condizioni imposte per il corretto utilizzo dell'energia libera sono quelle di mantenere temperatura e pressione costanti. Sebbene tali restrizioni sembrino frustranti, possono essere abbastanza facilmente realizzate nei comuni laboratori. Vi ricordo, a titolo di esempio, che usualmente il sistema Uomo è sottoposto alla pressione costante di una atmosfera e "lavora" alla temperatura costante di circa 37° C.
L'ENERGIA LIBERA
Definizione
L'energia libera viene definita come la differenza tra l'energia complessiva del sistema ed un termine di energia di natura entropica.
| A = U - TS | 4.1 |
Nella pratica risulta più conveniente la cosiddetta entalpia libera (comunemente detta energia libera di Gibbs), definita nel modo seguente
| G = H - TS | 4.2 |
A e G sono entrambe funzioni di stato, dipendono dalla temperatura e dalla pressione e sono variabili estensive. Il valore assoluto dell'energia libera di un sistema, come per l'entalpia, non è noto, pertanto, come vedremo, si utilizzano solo le variazioni di questa funzione termodinamica.
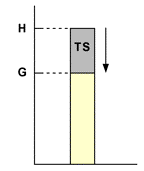 Il primo termine dell'energia libera (H) dipende dalla temperatura in maniera implicita e rappresenta l’energia complessiva del sistema. il secondo termine (TS, detto anche energia legata) dipende dalla temperatura sia in maniera esplicita che implicita; rappresenta quella quantità di energia non sfruttabile dal sistema, perché intimamente legata alla sua organizzazione strutturale (termine entropico). Possiamo dire che G rappresenta la massima quantità di energia del sistema che è disponibile per essere convertita in lavoro.
Il primo termine dell'energia libera (H) dipende dalla temperatura in maniera implicita e rappresenta l’energia complessiva del sistema. il secondo termine (TS, detto anche energia legata) dipende dalla temperatura sia in maniera esplicita che implicita; rappresenta quella quantità di energia non sfruttabile dal sistema, perché intimamente legata alla sua organizzazione strutturale (termine entropico). Possiamo dire che G rappresenta la massima quantità di energia del sistema che è disponibile per essere convertita in lavoro.
ENERGIA LIBERA e SPONTANEITA'
E' dimostrabile che a temperatura e pressione costante avvengono spontaneamente quei processi che procedono verso la diminuzione di energia libera del sistema fino a condurre ad un valore minimo della sua energia libera. Nella figura seguente viene rappresentato il profilo energetico di un sistema reattivo nel quale l'equilibrio è leggermente spostato verso i prodotti; per esso, partendo da una situazione iniziale (1) in cui l'energia libera del sistema è G1 , si avrà una evoluzione spontanea verso lo stato di equilibrio (2) in cui l'energia libera del sistema G2 è quella minima.
Il processo inverso da (2) a (1) (da G2 a G1), oppure una continuazione nella precedente direzione verso ulteriore formazione di prodotti (3) (da G2 a G3), aldilà dello stato di equilibrio, necessita di energia che deve essere in qualche modo fornita al sistema e pertanto non sarà spontaneo.
In definitiva un processo spontaneo rilascia sempre verso l'ambiente una certa quantità di energia libera, molto spesso sotto forma di calore, e il sistema raggiunge uno stato energetico termodinamicamente stabile di equilibrio.
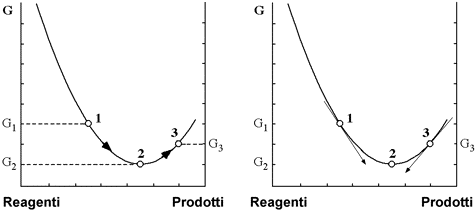
Indichiamo come direzione predefinita quella che va dai reagenti verso i prodotti e osserviamo la parte destra della figura. In termini differenziali, un processo procede lungo la direzione predefinita se dG<0 (pendenza negativa), evolve in senso inverso se dG>0 (pendenza positiva) ed infine si trova in uno stato di equilibrio se dG=0 (in un minimo di energia libera del sistema in cui la pendenza nulla).
In altri termini, un sistema evolve spontaneamente verso una condizione di equilibrio, sia nel caso in cui la variazione di energia libera per il sistema è negativa sia nel caso in cui è positiva. Il termine "spontaneo" quando è accoppiato al termine "termodinamico", vedremo che ha un altro significato rispetto a quello che gli compete nella lingua italiana e che abbiamo utilizzato finora.
Energia libera standard di reazione.
Per determinare l'energia libera standard di una reazione si può fare ricorso alle tabelle di energia libera molari standard di formazione. Quest'ultima grandezza è definita (analogamente all'entalpia standard di formazione) come la differenza di energia libera della reazione di formazione di una mole di composto.
| ΔG°reazione di formazione = ΔG°f = G °composto | 4.3 |
| ΔG°reazione = G°prodotti - G°reagenti | 4.4 |
Per il calcolo del ΔG°reazione valgono le stesse regole utilizzate per il ΔH°reazione tenendo conto che, come già visto per l’entalpia, per convenzione ΔGf° a 298K è nullo per tutte le specie elementari. Riepilogando, nelle tabelle dei dati chimico-fisici si trovano ΔH°f , ΔS°f e ΔG°f di composti e di elementi, per questi ultimi sono nulli i valori di ΔH°f , ΔG°f mentre si hanno, ovviamente, valori finiti di entropia di formazione. I valori di ΔG°f dei composti sono ricavati dagli altri due dati termodinamici mediante l'espressione (4.6) che vedremo fra poche righe.
A temperatura e pressione costante, sempre riferendoci al sistema reazione, il calcolo può essere effettuato differenziando l’espressione di definizione (4.2).
| dGreazione = dHreazione - d(T S)reazione | 4.5 |
In termini finiti e "a temperatura e pressione costante" l'equazione di Gibbs-Helmholtz diventa:
| ΔGreazione = ΔHreazione - T ΔSreazione | 4.5b |
La (4.5) è valida se ΔHreazione e ΔSreazione si riferiscono alla temperatura T. In condizioni standard (T=298K):
| ΔG°reazione = ΔH°reazione - T° ΔS°reazione | 4.6 |
Se la temperatura non è quella standard di 25°C, l'espressione (4.6) non è valida e può essere usata solo per "stimare" i valori di ΔGsistema purchè la temperatura non si discosti troppo dal valore cui si riferiscono il ΔHsistema e ΔSsistema. La relazione precedente (4.6) ci permette di predire con esattezza la direzione di un processo chimico quando lo stesso si trova nelle condizioni standard. Questo concetto viene definito spontaneità termodinamica e non indica se un processo avviene o non avviene, ma ne prevede la direzione, e magari di quanto procede in quella direzione, a partire dalle condizioni iniziali (quelle standard nel caso specifico). Risulta ovvio che se il valore del ΔG° di una reazione, ad esempio, assume valori molto negativi, i prodotti saranno certamente favoriti e la reazione avverrà prevalentemente verso destra. Diversamente, se il valore di ΔG° assume valori molto positivi la reazione risulterà sfavorita, spostata prevalentemente verso sinistra. Se le condizioni di lavoro sono drasticamente diverse da quelle standard, il ΔG°sistema potrebbe fornire indicazioni non coerenti con quanto appena detto. In biochimica, lo standard viene modificato nel ben noto ΔG°' proprio per evitare l'incoerenza accennata.
Il valore del ΔG°reazione, come vedremo in seguito, è legato al valore della costante di equilibrio di una reazione. I termini eso ed endoergonico si riferiscono al segno ΔG° di reazione:
| Reazione ESOERGONICA | ΔG°reazione < 0 | |
| Reazione ENDOERGONICA | ΔG°reazione > 0 |
ENERGIA LIBERA MOLARE E POTENZIALE CHIMICO
 |
|
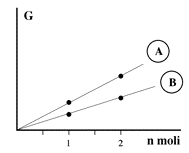
| Energia libera per le specie chimiche pure A e B vs. la quantità di sostanza. |
Sebbene non sia possibile conoscere il valore assoluto dell'energia libera posseduta da una mole di sostanza pura, trattandosi di una proprietà estensiva, il valore di energia libera di due moli deve valere il doppio di quella posseduta da una mole. Il valore posseduto da una mole di sostanza pura è detto energia libera molare (GM).
L'energia libera molare è uguale all'energia libera posseduta da una certa quantità di sostanza pura diviso il numero di moli di cui essa è costituita: un valore specifico. Rappresenta, se volete, la pendenza della retta ottenibile mettendo in grafico l'energia libera in funzione del numero di moli.
Se GM è definita in condizioni standard (25°C e 1 Bar) si parla di energia libera molare in condizioni standard (GM°). E' possibile dimostrare che il valore dell'energia libera molare, differisce da quello posseduto da una mole in condizioni standard per un termine dipendente dalla temperatura e dal logaritmo della "attività" della specie chimica in questione.
| GM = GM° + RT ln a | 4.7 |
| GMi = GM°i + RT ln ai | 4.7b |
Pur essendo adimensionale, l'attività discende da un rapporto di quantità definite nel modo seguente:
| Per un gas l'attività è un termine di pressione (P/P°) Per un soluto l'attività è un ternime di concentrazione (m/m°) Per solidi e liquidi puri l'attività vale 1 |
Se il sistema non è ideale i valori di pressione e concentrazione devono essere corretti mediante un apposito coefficiente, detto coefficiente di attività (o di fugacità nel caso dei gas). Per un soluto disciolto in un solvente, in termini molto qualitativi, l'attività non è la concentrazione reale, ma quella che effettivamente agisce e risulta attiva ai fini del processo considerato.
| a = γ .C | 4.8 |
I coefficienti di attività sono ricavabili solo sperimentalmente. Nel caso dei soluti che si comportano da elettroliti, Peter Debye ed Erich Huckel hanno dimostrato che, almeno per concentrazioni non troppo elevate (<0.02 Molare) è possibile esprimere il coefficiente di attività in funzione della forza ionica globale Γ della soluzione secondo la seguente relazione:
| 4.9 |
Per concentrazioni maggiori esistono espressioni di Debye e Huckel più complesse. Nell'espressione semplificata, "A" è una costante che dipende dal solvente (0.51 per l'acqua); "z+" e "z-" sono rispettivamente la carica del catione e dell'anione; "Γ" (gamma maiuscolo) è la forza ionica, definita come la semisomma dei prodotti tra le concentrazioni e la carica degli ioni al quadrato:
| |
4.10 |
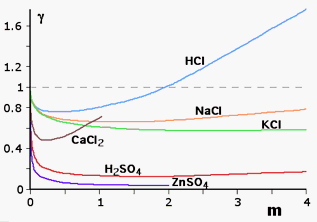
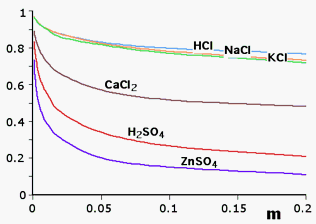
La forza ionica di una soluzione è un indice della quantità di ioni in soluzione e dell'intensità del campo elettrico che essi producono. Per parecchi soluti ionici, il valore medio del coefficiente di attività, in soluzioni molto diluite, risulta molto prossimo al valore unitario (nota: attività e concentrazione coincidono). Nella tabella che segue sono riportati i coefficienti di attività medi sperimentali di alcune specie chimiche in soluzione a varie concentrazioni anche molto elevate (la forza ionica è quella dovuta all'unico soluto presente in soluzione)
| Coefficienti di attività medi di alcuni elettroliti in funzione della conc. molale | ||||||
| m | HCl | H2SO4 | NaCl | KCl | ZnSO4 | CaCl2 |
| 0.001 | 0.966 | 0.830 | 0.966 | 0.965 | 0.73 | 0.89 |
| 0.002 | 0.952 | 0.757 | 0.953 | 0.952 | 0.61 | 0.85 |
| 0.005 | 0.928 | 0.639 | 0.929 | 0.927 | 0.48 | 0.785 |
| 0.01 | 0.904 | 0.554 | 0.904 | 0.901 | 0.39 | 0.725 |
| 0.02 | 0.875 | 0.453 | 0.875 | 0.31 | 0.66 | |
| 0.05 | 0.830 | 0.340 | 0.823 | 0.815 | 0.2 | 0.57 |
| 0.1 | 0.796 | 0.265 | 0.780 | 0.769 | 0.15 | 0.515 |
| 0.2 | 0.767 | 0.209 | 0.730 | 0.719 | 0.11 | 0.48 |
| 0.5 | 0.758 | 0.154 | 0.68 | 0.651 | 0.063 | 0.52 |
| 1.0 | 0.809 | 0.130 | 0.66 | 0.606 | 0.043 | 0.71 |
| 2.0 | 1.01 | 0.124 | 0.67 | 0.576 | 0.035 | |
| 4.0 | 1.76 | 0.171 | 0.78 | 0.579 | ||
La forza ionica delle soluzioni dipende da tutti i soluti ionizzabili presenti e non esclusivamente da quello o quelli di cui siamo direttamente interessati. La presenza di ioni "estranei" che producono un proprio campo elettrico, altera le interazioni tra gli ioni e quindi l'attività degli stessi.
Variazioni di Energia libera nelle reazioni chimiche
Utilizziamo il generico schema di reazione:
|
a A + b B |
La differenza di energia libera dei prodotti e quella dei reagenti si ottiene considerando l'energia libera molare di ogni componente moltiplicato per il coefficiente stechiometrico:
ΔG = |
Gprodotti - Greagenti = [c GMC + d GMD] - [a GMA + b GMB ] |
ΔG = |
[c GM°C + c RT ln aC + d GM°D + d RT ln aD ] - [ a GM°A + a RT ln aA + b GM°B + b RT ln aB ] |
Ordinando i termini molari standard e i termini "RT ln a", e mettendo RT in evidenza:
ΔG = |
[c GM°C + d GM°D - a GM°A - b GM°B ] + RT [c ln aC + d ln aD - a ln aA - b ln aB ] |
Il primo termine in parentesi quadra è la variazione di energia libera standard della reazione. Il secondo termine, in base alle proprietà dei logaritmi prevede la forma tipica di un quoziente di reazione (adesso le parentesi tonde indicano l'attività):
|
4.11 |
L'espressione ricavata fornisce la differenza di energia libera nelle generiche condizioni di partenza utilizzate, e cioè con le attività specificate per i reagenti e per i prodotti. Il sistema tenderà ad evolvere verso le condizioni di equilibrio e, quando saranno raggiunte, il quoziente di reazione assumerà il valore della costante di equilibrio e pertanto la differenza di energia libera risulterà nulla:
| Condizioni di equilibrio |
|
Da cui deduciamo la seguente relazione tra la differenza di energia libera molare standard e la costante di equilibrio di una reazione:
|
4.12 |
In definitiva il formalismo termodinamico ci permette di prevedere le condizioni di equilibrio per una reazione mentre l'insieme dei parametri termodinamici ci può consentire di stabilire le modalità con cui essa si modifica per effetto di componenti estranei che sembrano solo spettatori.
| Relazione, a 25°C, tra costante di equilibrio e variazione di energia libera molare standard (ΔGM° è espressa sia in kcal mol-1 che in kJoule mol-1) Reagenti
|
|
|||||||||||||||||||||||||||||||||||||||||||||||
Ad esempio per la reazione: Cdiamante ![]() Cgrafite troviamo tabulati i seguenti dati termodinamici
Cgrafite troviamo tabulati i seguenti dati termodinamici
| ΔH°f (kJ mol-1) | S° (J mol-1 K-1 | |
| Grafite | 0 | 5.740 |
| Diamante | 1.895 | 2.377 |
La variazione di energia libera standard per la reazione vale:
ΔG°reaz. = ΔH°reaz. - T° ΔS°reaz. = (–1895) – 298.15 • (5.74 – 2.377) = –2898 J/mol
Dal punto di vista termodinamico la reazione di conversione è spontanea (ΔG°reaz.<0). Questo significa che a 25°C il diamante tende a trasformarsi in grafite con un rapporto, ricavato dal ΔG°reaz., di circa 3/1 a favore della grafite. I tempi necessari per tale trasformazione sono estremamente lunghi.
Costante di equilibrio e temperatura
La costante di equilibrio di una reazione può essere determinata analiticamente misurando la concentrazione all'equilibrio di tutte le specie chimiche che ne prendono parte, magari attraverso un opportuno utilizzo di metodologie di natura spettroscopica.
Il valore della costante di equilibrio può dipendere dalla temperatura in maniera più o meno marcata; l'entità di tale dipendenza è in relazione alla variazione di entalpia della reazione stessa.
Qualitativamente il modo con cui un equilibrio risponde ad una variazione di temperatura è prevedibile in base al principio di Le Chatelier. Il valore di Keq per una reazione esotermica diminuisce all'aumentare della temperatura ed, inversamente, per una reazione endotermica, il valore di Keq aumenta all'aumentare della temperatura.
Van't Hoff ha dedotto una relazione quantitativa tra il valore di Keq e la temperatura assoluta per una reazione che avvenga a pressione costante.
Quello che segue è un semplice metodo per ricavare la relazione esistente tra la Keq e la temperatura. Per una reazione chimica (4.6):
| 4.13 |
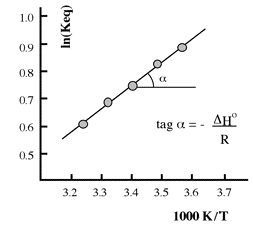 Per una reazione chimica, in un intorno non molto ampio (±15°) di temperatura, esiste una relazione lineare tra i valori del logaritmo delle costanti di equilibrio in funzione dell'inverso della temperatura assoluta.
Per una reazione chimica, in un intorno non molto ampio (±15°) di temperatura, esiste una relazione lineare tra i valori del logaritmo delle costanti di equilibrio in funzione dell'inverso della temperatura assoluta.
Con un semplice procedimento di minimi quadrati lineari è facile ottimizzare il valore della pendenza (tagα) della retta ottenuta. Da quest'ultima infine si ricava il ΔH°.
Per una determinazione approssimativa è necessario effettuare almeno due determinazioni di Keq, a due temperature diverse, nell'intorno della temperatura standard di 25°C, ma è ovvio che l'entità dell'errore in queste condizioni sarà maggiore.
Estratto concettuale minimale di termodinamica