(Per ulteriori informazioni: Schiavello-Palmisano, "Fondamenti di CHIMICA", II ed., cap. 15.3)
PREMESSA
L'equilibrio chimico può essere studiato, in maniera rigorosa e formalmente corretta, utilizzando i potenziali termodinamici. Un'altra possibilità è quella di interpretare il concetto di equilibrio chimico in termini cinetici. Questa modalità, certamente più semplice ed intuitiva, è spesso ritenuta fuorviante da alcuni addetti ai lavori. Per ridurre al minimo le possibili interpretazioni errate è necessario dichiarare e mettere subito in evidenza che l'approccio cinetico non è di carattere generale ma che dipende, almeno per quel che concerne la dimostrazione e non certamente i risultati, dal meccanismo con cui realmente si verifica il particolare processo preso in considerazione.
NOTA: Attenzione alla distinzione tra il termine "prodotto" come risultato aritmetico rispetto al "prodotto" nel senso di sostanza chimica che viene ottenuta (prodotta) come risultato di una reazione chimica
L'equilibrio
La possibilità che si instauri un equilibrio chimico è dovuta al fatto che i cosiddetti "prodotti" di una reazione possono a loro volta reagire per ripristinare i reagenti da cui sono ottenuti. Si deve trattare di un processo che può avvenire in direzione opposta (invertibile). Non utilizzate la parola "reversibile" che ha un significato termodinamico particolare.
Si consideri, ad esempio, un processo in fase omogenea (gassosa per semplicità) rigorosamente bimolecolare che avvenga con il meccanismo semplice descritto dallo schema di reazione proposto di seguito. In altri termini il processo reattivo deve essere attribuito al semplice urto efficace dei reagent (messi a sinistra)i, senza alcun processo intermedio prima di "arrivare" ai prodotti (messi a destra).
| A | + | B | C | + | D |
Supponiamo di mescolare, in un tempo sufficientemente breve, le giuste quantità delle specie gassose "A" e "B" realizzando precise e note concentrazioni (che non devono risultare necessariamente uguali). Statisticamente si verificheranno un certo numero di urti efficaci nell'unità di tempo; tale numero dipende dalla temperatura (energia cinetica media delle particelle) e pertanto, per escludere questa variabile dal nostro studio, ci premureremo a mantenerla costante mediante l'uso di opportuni termostati. Il numero degli urti efficaci dipende ancora dalla concentrazione delle specie gassose, dalla facilità con cui si possono rompere i vecchi legami e dalle condizioni steriche che rendono più o meno difficile la collisione nella giusta direzione tra le molecole reagenti. Le ultime due caratteristiche sono da considerarsi intrinseche al sistema reattivo, pertanto l'unica variabile che rimane "attiva" è la concentrazione delle specie reagenti.
In conclusione, la velocità con cui i reagenti formano i prodotti (velocità diretta vd) dipende da una costante (costante cinetica k) che ingloba sia le caratteristiche intrinseche del sistema che la dipendenza dalla temperatura e, ovviamente, dalle concentrazioni delle specie reagenti:
![]()
Con il trascorrere del tempo, la concentrazione delle specie reagenti diminuisce e, di conseguenza, analoga sorte subisce la velocità diretta. Dal canto loro i prodotti, inizialmente a concentrazione nulla, con il passare del tempo tendono a crescere in quantità e concentrazione e così pure la velocità con cui producono i reagenti. La velocità inversa, infatti, è anch'essa funzione della concentrazione e di una costante cinetica normalmente di valore differente rispetto alla costante diretta:
![]()
Dopo un certo tempo, dipendente dal tipo di processo (dai microsecondi agli anni), la velocità inversa in crescita e quella diretta in diminuzione si uguaglieranno. Da quel momento in poi un osservatore esterno noterà che, se non si interviene, le concentrazioni delle quattro specie chimiche presenti rimarranno invariate. Questa è l'ovvia conseguenza del fatto che la velocità con cui i reagenti continuano a formare i prodotti è uguale alla velocità con cui i prodotti ripristinano i reagenti. In altri termini, mentre le due reazioni continuano ad avvenire, le concentrazioni delle sostanze che intervengono nel processo rimangono costanti.
La condizione alla quale siamo pervenuti è la condizione di equilibrio della reazione considerata. Si parla di equilibrio dinamico proprio per il fatto che le due reazioni concorrenti continuano ad avvenire nonostante la costanza delle concentrazioni di tutte le specie presenti.
La legge di Azione di Massa (Guldberg e Waage)
Quando si raggiunge la condizione di equilibrio, le due velocità, quella diretta e quella inversa, risultano uguali. Possiamo pertanto scrivere:
![]()
da questa equazione, ponendo il rapporto tra le due costanti (diretta ed inversa) uguale da una terza costante, detta costante di equilibrio delle concentrazioni, avremo:
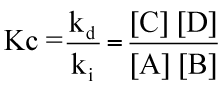
In questa espressione, nonostante i simboli siano rimasti gli stessi, le concentrazioni indicate si riferiscono i valori assunti quando il sistema è in condizioni di equilibrio, non sono quelli inizialmente presenti all'atto del mescolamento.
Più in generale, per una generica reazione del tipo:
| a A | + | b B | c C | + | d D |
si scriverà
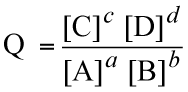
Il "prodotto delle concentrazioni dei prodotti" diviso il "prodotto delle concentrazioni dei reagenti", in cui ciascun termine di concentrazione elevato al coefficiente stechiometrico di riferimento, si chiama quoziente di reazione "Q". Quando le concentrazioni sono quelle all'equilibrio, tale espressione assume il valore numerico relativo alla costante di equilibrio delle concentrazioni di quella particolare reazione a quella determinata temperatura:
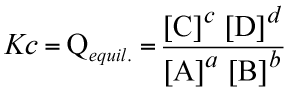 |
La legge di Azione di Massa (Guldberg e Waage) |
Note sui valori di Kc - Il valore della costante di equilibrio delle concentrazioni è una caratteristica di ogni reazione e dipende in maniera più o meno marcata dalla temperatura. Valori molto alti indicano che la reazione tende a formare un quantitativo di prodotti elevato (reazione spostata verso destra). Valori molto piccoli indicano che la reazione procede abbastanza poco (reazione spostata verso sinistra). Le indicazioni fornite dal valori di Kc sono qualitative, per una effettiva considerazione sul grado di avanzamento di una reazione bisogna anche tenere conto dei coefficienti stechiometrici.
Principio dell'equilibrio mobile (Le Chatelier)
Se ad un sistema in condizioni di equilibrio si causano delle modifiche "ai parametri che lo controllano", il sistema tenderà ad opporsi alle variazioni apportate in modo da minimizzarle o comunque ridurle. Tra i parametri che possono controllare un equilibrio chimico includiamo Pressione, Temperatura e Concentrzione delle sostanze. Quello che può verificarsi è una modifica della condizione di equilibrio o addirittura una variazione del valore della costante di equilibrio. A tale proposito seguono alcuni esempi.
Es. 1 - Si consideri la seguente generica reazione già in condizioni di equilibrio
| a A | + | b B | c C | + | d D |
Se si aumenta la concentrazione di un reagente, il sistema reagisce spostando l'equilibrio verso destra consumando parzialmente il reagente aggiunto (e anche l'altro reagente). In pratica, come vedremo negli esercizi, il sistema riporta il quoziente, modificato a causa dell'aggiunta, al valore della costante di equilibrio della reazione in questione.
Es. 2 - Si consideri la seguente generica reazione già in condizioni di equilibrio
| a A | + | b B | c C | + | d D |
Se si aumenta la concentrazione di un prodotto, il sistema reagisce spostando l'equilibrio verso sinistra consumando parzialmente il prodotto aggiunto (ed anche l'altro prodotto). Anche in questo caso il sistema riporta il valore del quoziente al valore della costante di equilibrio della reazione in questione.
Es. 3-4 - Si consideri la seguente generica reazione già in condizioni di equilibrio
| a A | + | b B | c C | + | d D |
Se si diminuisce la concentrazione di un reagente o di un prodotto, in maniera complementare agli esempi 1 e 2, il sistema reagisce spostando l'equilibrio per ripristinare parzialmente il componente sottratto all'equilibrio riportando il valore del quoziente al valore della costante di equilibrio della reazione in questione.
In termini generali, una variazione di pressione in un equilibrio in fase gassosa, farà spostare l'equilibrio verso una diminuzione o un aumento del numero di particelle che contribuiscono al valore della pressione, in modo da opporsi alla variazione apportata. Nel caso in cui il numero di particelle presenti tra i reagenti e i prodotti è uguale, il sistema non può opporsi alla variazione della pressione.
Es. 5 - Si consideri la seguente reazione in fase gassosa:
| A | + | B | C |
Se si provoca un aumento della pressione del sistema reazione, il sistema reagisce tentando di ridurre tale incremento. In questo caso può farlo spostando l'equilibrio verso destra perché in tal modo si otterrà una diminuzione del numero di particelle. Viceversa, se si provoca una diminuzione della pressione, il sistema reagisce spostando l'equilibrio verso sinistra perché in tal modo si otterrà un aumento del numero di particelle.
Es. 6 - Si consideri la seguente reazione di dissociazione in fase gassosa:
| PCl5(g) | PCl3(g) | + | Cl2(g) |
Se si provoca un aumento della pressione del sistema reazione, il sistema reagisce tentando di ridurre tale incremento. In questo caso può farlo spostando l'equilibrio verso sinistra perché in tal modo si otterrà una diminuzione del numero di particelle. Viceversa, se si provoca una diminuzione della pressione, il sistema reagisce spostando l'equilibrio verso destra perché in tal modo si otterrà un aumento del numero di particelle.
Una variazione di temperatura, se la reazione presa in considerazione è endotermica o esotermica, provoca una modifica del valore della costante di equilibrio nella direzione che permette al sistema di opporsi alla variazione apportata. Nel caso di reazioni quasi atermiche, il sistema non ha la possibilità di opporsi. In termini elementari, una reazione risulta endotermica quando utilizza calore, prelevandolo dall'ambiente, come fosse un reagente; viceversa, una reazione risulta esotermica quando produce calore riversandolo verso l'ambiente. Nel caso di reazioni di equilibrio, se la reazione scritta con un certo verso risulta esotermica, la reazione scritta con il verso opposto sarà ovviamente endotermica.
Es. 7 - Si consideri la seguente generica reazione scritta nel verso esotermico (calore ottenuto come prodotto):
| a A | + | b B | c C | + | d D | + m kJoule |
Se si riscalda il sistema allo scopo di aumentarne la temperatura, il sistema reagisce tentando di ridurre tale aumento. In questo caso si osserverà una diminuzione della costante di equilibrio che ha lo stesso effetto di spostare l'equilibrio verso sinistra, consumando calore come fosse un reattivo (verso endotermico). Inversamente se si raffredda il sistema allo scopo di diminuirne la temperatura, si avrà un aumento del valore della costante di equilibrio che ha lo stesso effetto di spostare l'equilibrio verso destra producendo calore come prodotto (verso esotermico).
Es. 8 - Si consideri la reazione di sintesi dell'ammoniaca (reaz. esotermica):
| N2(g) | + | 3 H2(g) | 2 NH3(g) | + 46 kJoule/mol |
Lo scopo principale è quello di ottenere una buona resa nel prodotto utile (l'ammoniaca). Pertanto si devono trovare le migliori condizioni per spostare l'equilibro verso la formazione dell'ammoniaca.
| (a) |
Va bene un valore elevato di pressione perché spinge l'equilibrio verso la diminuzione del numero di particelle (verso destra).
|
| (b) | Va bene mantenere basso il valore della temperatura (sottrarre calore mentre si produce) per aumentare il valore della costante di equilibrio. |