Relazione Kp Kc
Il quoziente relativo ad un sitema reattivo che fa riferimento alle pressioni parziali dei componenti, quando si è in condizioni di equilibrio, prende il nome di costante di equilibiro delle pressioni parziali. Ad esempio si consideri la reazione di formazione dell'ammoniaca in cui tutti i componenti sono in fase gassosa:
| N2(g) | + | 3 H2(g) | 2 NH3(g) |
per essa potremo scrivere:
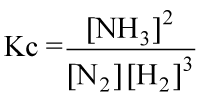 |
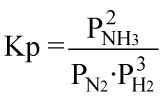 |
Dall'equazione di stato deduciamo che P = M R T ; sostuendo quest'ultima nell'espressione della Kp avremo:
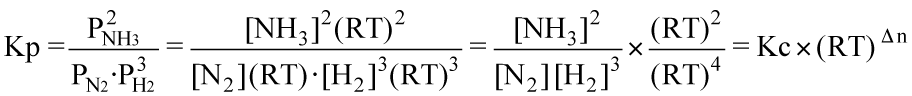
ove Δn rappresenta la differenza dei coefficienti stechiometrici tra prodotti e reagenti che in questo caso assume il valore (-2). Nell'esempio seguente
| PCl5(g) | PCl3(g) | + | Cl2(g) |
il valore di Δn assume il valore unitario.
La relazione Kp-Kc può essere scritta anche nella seguente forma: