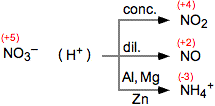
LE OSSIDORIDUZIONI E IL LORO BILANCIO
|
| H2O2 |
(ambiente acido) |
| H2O2 + 2 OH– |
(ambiente basico) |
Reazioni di dismutazione (o disproporzione)
Sono reazioni nelle quali una specie chimica si ossida e contemporaneamente si
riduce, producendo due specie chimiche distinte contenenti lo stesso elemento ma
con stato di ossidazione differente. Per bilanciare una reazione di questo tipo si
deve tenere conto che la specie contenente l'elemento nello stato di ossidazione
maggiore riguarda la semireazione di ossidazione, mentre quella con l'elemento nello
stato di ossidazione minore riguarda la semireazione di riduzione.
Qui di seguito vi propongo alcuni esempi di disproporzione molto noti in
chimica inorganica (le reazioni non sono bilanciate):
S + NaOH ![]() Na2S +
Na2S2O3
Na2S +
Na2S2O3
P + NaOH ![]() PH3 + NaH2PO2
PH3 + NaH2PO2
Cl2 + NaOH ![]() NaCl
+ NaClO (a caldo l'ipoclorito dismuta ulteriormente a cloruro e clorato)
NaCl
+ NaClO (a caldo l'ipoclorito dismuta ulteriormente a cloruro e clorato)
Radicali all'ossigeno nei sistemi biologici:
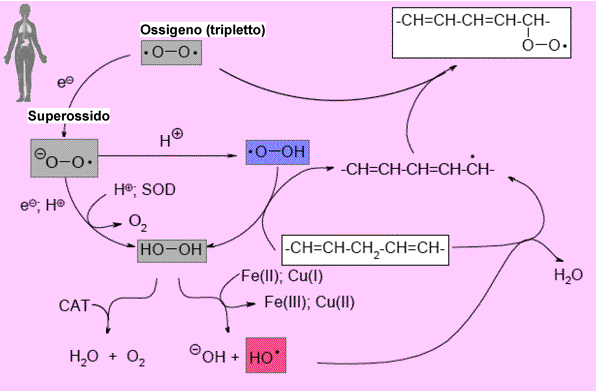
In ambiente fisiologico, ad esempio durante la respirazione mitocondriale, si forma l'anione superossido, un radicale libero, che tende a dismutare spontaneamente in diossigeno (O2) e perossido di diidrogeno (H2O2).
![]()
Per minimizzare la possibilità della formazione di derivati del superossido
altamente tossici, la reazione di dismutazione viene velocizzata dall'azione
catalitica di particolari enzimi detti superossodismutasi (SOD):
Le SOD sono metallo enzimi. Sono state descritte tre classi di SOD, ognuna
caratterizzata da un particolare sito attivo e dal metallo che partecipa al sito
attivo: Cu/Zn-SOD, Fe-SOD, Mn-SOD. La SOD Rame Zinco è caratteristica delle
cellule eucariote (citosol e nucleo), la Ferro SOD delle procariote e la Manganese
SOD si trova invece in entrambi i tipi di cellule (matrice mitocondriale). Questi
enzimi svolgono attività vitali
per gli organismi aerobici (Beyer, 1991). Pare abbiano azione protettiva contro i
radicali liberi in genere, riducono i danni al DNA, la perossidazione dei lipidi
e i danni dovuti alle radiazioni ionizzanti.
L'azione dei metalli consiste nell'agire da tramite per il trasferimento elettronico da un anione superossido all'altro; in un primo momento l'enzima viene ridotto da O2– e, in una seconda fase funge da riducente trasferendo l'elettrone prima ricevuto ad un altro radicale O2– riproponendosi inalterato per successivi eventi reattivi:
Cu2+-SOD + O2– ![]() Cu1+-SOD
+ O2
Cu1+-SOD
+ O2
Cu1+-SOD + O2– + 2H+ ![]() Cu2+-SOD + H2O2
Cu2+-SOD + H2O2
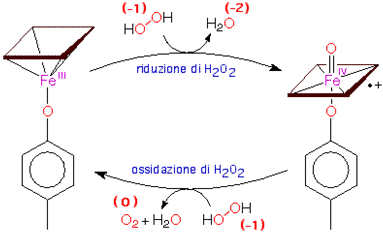
L'acqua ossigenata, che potrebbe anche essa produrre radicali liberi molto pericolosi, viene eliminata mediante altri enzimi (catalasi) che accelerano moltissimo il seguente processo di dismutazione:
H2O2 + H2O2 ![]() 2H2O + O2
2H2O + O2
La disproporzione dell'acqua ossigenata (ossigeno -1) consiste nella riduzione ad acqua (ossigeno -2) e nella ossidazione a diossigeno (ossigeno zero). Le catalasi sono enzimi che, come le SOD, agiscono intervenendo come tramite per il trasferimento elettronico tra due molecole di H2O2 e cioè agiscono da riducenti e, una volta ossidati, da ossidanti nei confronti di una seconda molecola.
H2O2 + Fe(III)-E ![]() H2O + O=Fe(IV)-E
H2O + O=Fe(IV)-E
H2O2 + O=Fe(IV)-E ![]() H2O + Fe(III)-E + O2
H2O + Fe(III)-E + O2
Nella figura seguente viene riproposto in maniera figurata lo stesso meccanismo; l'enzima viene rappresentato schematicamente a sinistra con il ferro fuori piano nella sua forma ridotta, a destra nella sua forma ossidata con il ferro nel piano del gruppo eme.
Approfondimenti:
Radicali all'ossigeno nei sistemi biologici: ( file
pdf locale ) ( link
al sito originale )
Il danno prodotto dai radicali liberi a carico delle membrane cellulari: (
file html locale )
Il bilanciamento delle redox con il metodo ionico elettronico
Alcune reazioni redox sono talmente semplici (reaz. di combustione, di sintesi,
di decomposizione, di spostamento etc.) che si possono bilanciare "ad
occhio" per tentativi meditati o mediante il metodo elettronico
(semplice conteggio degli elettroni ceduti e acquistati).
Nel caso in cui il numero di reagenti e di prodotti è consistente, i tentativi, seppur ben meditati, spesso non permettono di approdare al bilancio soprattutto perchè inducono confusione. In questi casi conviene ricorrere a metodi che dividono il processo in semireazioni e impongono alcune regole in sequenza che, a piccoli passi, permettono di conseguire il risultato voluto.
In questa sezione tenterò di spiegare passo passo il bilanciamento
delle reazioni di ossidoriduzione con il metodo ionico elettronico.
Quest'ultimo metodo è da preferire per due semplici motivi: a) fornisce
anche il bilanciamento del solvente, b) le reazioni redox negli
esseri viventi avvengono prevalentemente in fluidi acquosi e le sostanze sono presenti
generalmente sotto forma di ioni, pertanto è bene cominciare a prendere confidenza
con questa tipologia di specie chimiche.
Se le reazioni non avvengono in soluzione, il metodo da utilizzare è quello semplicemente
elettronico.
Alcuni libri di testo descrivono il metodo con sequenze diverse; se vi aggrada seguite pure il metodo del libro che possedete.
Descriverò il metodo con due esempi, uno riguarda una reazione redox in ambiente acido, e l'altro una reazione redox in ambiente basico. Cominciamo con il primo esempio.
Si supponga di mettere a reagire il dicromato di potassio, in ambiente acido per acido solforico, con una soluzione di acqua ossigenata:
| K2Cr2O7 + H2O2 +
H2SO4 |
In base a quanto detto prima parlando degli ossidanti comuni, i prodotti sono facilmente prevedibili e dovrebbero essere i seguenti :
| K2Cr2O7 + H2O2 +
H2SO4 |
Ai prodotti previsti in base alla reciproca azione dell'ossidante e del riducente,
occorre aggiungere il metallo spettatore (potassio) e sicuramente acqua (non ci sono
atomi di idrogeno in nessuno dei prodotti inseriti, mentre ci sono tra i reagenti).
La posizione e la quantità di
molecole di acqua ci verranno comunque indicate dal metodo ionico elettronico.
La descrizione prevede 9 passi. Nella pratica, contrariamente alla descrizione che
segue, il percorso dal passo (3) al passo (5) viene
ripetuto separatamente per le due semireazioni del processo redox. Spero che il tentativo
di evitare ripetizioni non produca come risultato una riduzione eccessiva di chiarezza.
Metodo ionico elettronico: esempio in ambiente acido
1) Individuare correttamente ed evidenziare gli elementi
che si ossidano e si riducono, dopo attenta valutazione del numero di ossidazione
di tutti gli elementi partecipanti alla reazione.
Nel nostro caso notiamo il cromo che dallo stato di ossidazione (+6) passa a (+3),
quindi si riduce ed è l'ossidante. L'ossigeno dell'acqua ossigenata da
(-1) viene ossidato a zero nel diossigeno. Per evidenziare lo stato di ossidazione,
utilizzare il numero inserito in un cerchietto (in queste pagine HTML io ho usato
una parentesi ed il colore rosso)
2) Scrivere due semireazioni, una per la riduzione
e l'altra per l'ossidazione (L'ordine può essere casuale) ponendo a sinistra
l'elemento, lo ione o la molecola neutra che contiene la specie chimica che si ossida
o si riduce e, a destra della freccia di reazione, la specie prodotto della ossidazione
o della riduzione. La freccia di reazione si usa metterla abbastanza distanziata
con lo scopo di poter inserire altri componenti eventualmente necessari al bilanciamento.
Ricordarsi di eseguire il bilancio preventivo delle masse. Questo caso riguarda le
specie eventualmente presenti con un numero di atomi superiore a uno negli ioni o
nelle molecole neutre. E' proprio questo il caso del dicromato:
 |
3) Scrivere gli elettroni trasferiti, avendo cura di farli precedere sempre dal segno "+". Per intenderci, se gli elettroni vengono persi dalla specie scritta a sinistra, vanno scritti con il segno + sul lato destro della semireazione. Nel nostro esempio, il numero di elettroni risulta doppio rispetto alla variazione dello stato di ossidazione perchè, in entrambe le semireazioni, gli atomi interessati sono due. Vi consiglio di evidenziare la carica negativa degli elettroni.
 |
4) Bilanciare le cariche "libere" utilizzando ioni H+ o OH– a seconda se la reazione viene condotta in ambiente acido o basico. Per cariche libere si intendono le cariche degli ioni e quelle degli elettroni (per questo motivo ho isolato con le parentesi i numeri che rappresentano gli stati di ossidazione). Nella prima semireazione (guardare sopra) risultano 8 cariche negative a sinistra e 6 cariche positive a destra. Per annullare lo sbilancio occorrono 14 protoni a sinistra. Nella seconda reazione nessuna carica libera risulta presente a sinistra, mentre assommano a due le cariche negative presenti a destra: lo sbilancio viene colmato aggiungendo due protoni a destra. Ecco il risultato:
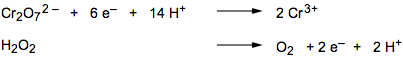 |
| Lo schema riportato a destra gradirebbe essere una sorta di aiuto grafico, quasi un conteggio al pallottoliere, per giustificare (o chiarire ulteriormente) il numero di ioni H+ che è necessario aggiungere sul lato sinistro della semireazione del dicromato allo scopo di equilibrare le cariche libere (8 negative a sinistra e 6 positive a destra). | 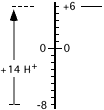 |
5) L'uso degli ioni H+ e OH– per bilanciare le cariche libere generalmente produce anche scompensi nel bilancio delle semireazioni; bisogna quindi ripristinare il bilancio delle masse mediante l'aggiunta del corretto numero di molecole di acqua a destra o a sinistra (secondo necessità). Vi ricordo che dovranno risultare bilanciati sia gli atomi di ossigeno che quelli di idrogeno: nel nostro caso l'aggiunta di 7 molecole di acqua alla destra della semireazione del dicromato bilancia sia i 14 H+ che i sette atomi di ossigeno presenti nello ione dicromato. La semireazione dell'H2O2 non necessita di ulteriori modifiche:
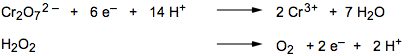 |
6) Bilanciare gli elettroni che complessivamente vengono scambiati tra la specie ossidante e la riducente moltiplicando le due semireazioni per i minimi coefficienti necessari. Nel nostro caso basta moltiplicare per 3 la semireazione dell'H2O2 : il numero minimo di elettroni trasferiti risulta pari a 6.
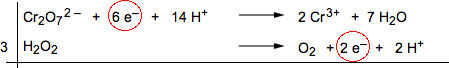 |
7) Effettuare la somma dei reagenti e dei prodotti delle singole semireazioni avendo cura di considerare i coefficienti moltiplicativi. Gli elettroni, invece, si possono escludere a priori dalla somma perchè, essendo eguali in numero, andrebbero comunque semplificati).
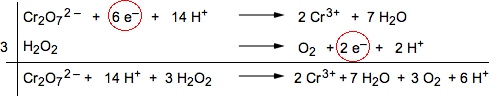 |
8) Semplificare per differenza le specie chimiche presenti contemporaneamente come reagenti e come prodotti.
9) Trasferire, infine, il risultato della somma nella forma molecolare della reazione.
Una buona regola per il trasferimento dei coefficienti
consiste nel considerare dapprima quelli che si riferiscono all'ossidante e alla
sua forma ridotta (a), poi quelli che si riferiscono al riducente e alla sua forma
ossidata (b). L'acqua va considerata bilanciata con il coefficiente ottenuto con
il metodo ionico elettronico (c). Alcune volte sono presenti degli ioni
spettatori che vanno aggiunti ai prodotti sotto forma di sali (d). Nel nostro caso
gli ioni spettatori sono gli ioni potassio(+1). Per ultimo bisogna prendere in considerazione
l'acido o la base che caratterizza l'ambiente acquoso di reazione (e).
| a | K2Cr2O7 + H2O2 +
H2SO4 |
| b | K2Cr2O7 + 3
H2O2 +
H2SO4 |
| c | K2Cr2O7 + 3
H2O2 + H2SO4 |
| d | K2Cr2O7 + 3
H2O2 + H2SO4 |
| e | K2Cr2O7 + 3
H2O2 + 4 H2SO4 |
| = | K2Cr2O7 + 3
H2O2 + 4 H2SO4 |
Metodo ionico elettronico: esempio in ambiente basico
Si supponga di mettere a reagire il permanganato di potassio, in ambiente basico per KOH, con una soluzione di ioduro di potassio:
| KMnO4 + KI |
(ambiente basico) |
Il prodotto derivante dalla riduzione del permanganato sarà prevalentemente il diossido di manganese, mentre potrebbe non essere noto il prodotto derivante dall'ossidazione dello ione ioduro (In questi casi, negli esercizi assegnati agli esami, verrà indicato il prodotto nel testo dell'esercizio):
| KMnO4 + KI |
(ambiente basico) |
Si noti che non si deve aggiungere l'idrossido di potassio come reagente; durante il corso della reazione, infatti, potrebbe prodursi ulteriore idrossido oltre a quello presente nell'ambiente (necessario ad innescare la reazione). La posizione e la quantità di molecole di acqua e di idrossido di potassio ci verranno indicate dal metodo ionico elettronico.
Ripetiamo i passaggi del metodo ionico elettronico:
1) Individuare correttamente gli elementi che si ossidano e si riducono.
2) Scrivere le due semireazioni, una per la riduzione
e l'altra per l'ossidazione con le stesse modalità specificate al punto 2 dell'esempio precedente.
Non è necessario nessun bilancio preventivo di masse
 |
3) Scrivere gli elettroni trasferiti.
 |
4) Bilanciare le cariche "libere" utilizzando ioni OH– perchè la reazione viene condotta in ambiente basico.
 |
5) Bilanciare le masse mediante molecole di acqua.
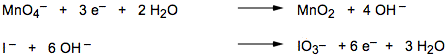 |
6) Bilanciare gli elettroni complessivamente scambiati tra la specie ossidante e la riducente. Nel nostro caso basta moltiplicare per due la semireazione del permanganato.
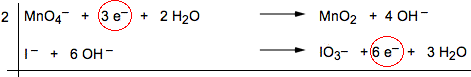 |
7) Effettuare la somma dei reagenti e dei prodotti delle singole semireazioni.
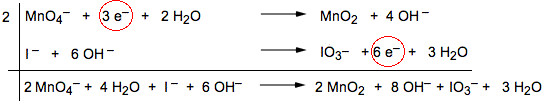 |
8) Semplificare per differenza le specie chimiche presenti contemporaneamente come reagenti e come prodotti.
9) Trasferire, infine, il risultato della somma nella forma molecolare della reazione.
| KMnO4 + KI |
|
| = | 2 KMnO4 + KI + H2O |