FORMULE CHIMICHE e Nomenclatura
Una formula chimica cerca di indicare in maniera concisa e simbolica una certa
sostanza, includendo il rapporto numerico tra gli atomi dei diversi elementi
che la compongono nella molecola o nel cristallo (ionico o covalente).
Alla sostanza
(o alla formula) bisogna assegnare un nome. Molte sostanze erano note da
prima che si conoscesse la loro formula chimica. Il nome che veniva
assegnato a queste sostanze derivava dalla fantasia, dal colore o da altre proprietà particolari:
per molte di esse, alla formula rappresentativa oggi si associa il nome già predisposto
in passato (nome corrente) che spesso è differente nelle diverse lingue nazionali.
Ben presto ci si avvide della necessità di assegnare un nome sistematico alle
sostanze chimiche e di predisporre un insieme di regole univoche di nomenclatura
(rimane irrisolto il problema delle lingue nazionali).
E' praticamente impossibile, dalla formula
chimica, prevedere o associare alla sostanza cui essa si riferisce, tutte le
proprietà
che si vorrebbero. Il comportamento
chimico di ogni singola sostanza o, almeno, di determinate famiglie di sostanze
va studiato sistematicamente e riguarda gli approfondimenti
di Chimica Inorganica e non certamente questa sede. Per questo motivo mi sembra fuori
luogo se non impossibile trattare l'argomento "NOMENCLATURA" pensando di
essere rigorosi sulle caratteristiche chimiche e chimico-fisiche delle sostanze di
cui, alla fine, per molte di esse si conosce solo il nome.
ESEMPI (in italiano):
| Formula |
nome corrente |
nome sistematico |
note (rapporto stechiometrico) |
| H2O |
acqua |
ossido di diidrogeno |
liquido con legame idrogeno (2:1) |
| NaCl |
sale da cucina |
cloruro di sodio |
solido ionico (1:1) |
| SiO2 |
Quarzo,
Tridimite,
Cristobalite |
diossido di silicio |
solido a reticolo covalente (1:2) |
Numero di ossidazione
Il numero o grado di ossidazione si può definire come:
"La carica che assumerebbe un elemento in un composto qualora
si attribuissero gli elettroni di legame all'elemento più elettronegativo".
| (a) |
Nel caso di un legame fra due atomi uguali si assegna un elettrone
a ciascun elemento (nessun conteggio di carica). |
| (b) |
La carica che l'elemento "assume", si determina dal confronto con
la configurazione elettronica esterna dell'elemento, nel suo stato fondamentale. |
Regole generali per assegnare i numeri di ossidazione
Quando si è in grado di rappresentare la formula di struttura
di un composto, il conteggio dei legami, tenendo conto delle differenze di elettronegatività,
permette di determinare lo stato di ossidazione di un atomo nella molecola, e
quindi lo stato di ossidazione medio di ogni elemento costituente la sostanza.
In caso contrario ci si può affidare alle seguenti semplici regole.
- Gli atomi degli elementi allo stato fondamentale hanno numero di ossidazione zero.
- Negli ioni monoatomici semplici il numero di ossidazione coincide con la carica (valenza
ionica) dello ione.
- La somma algebrica dei numeri di ossidazione degli elementi di una specie chimica
deve risultare pari alla carica della specie chimica (zero se neutra).
- Gli elementi allcalini e alcalino-terrosi nei loro composti presentano stati di ossidazione rispettivmente +1 e +2.
- Il fluoro nei composti ha sempre numero di ossidazione -1.
- L'idrogeno nei composti ha sempre numero di ossidazione +1, tranne che negli
idruri metallici (-1)
- L'ossigeno nei composti ha sempre numero di ossidazione -2, tranne nell'ossido di fluoro (+2), nei
perossidi (-1) e nei superossidi (-1/2).
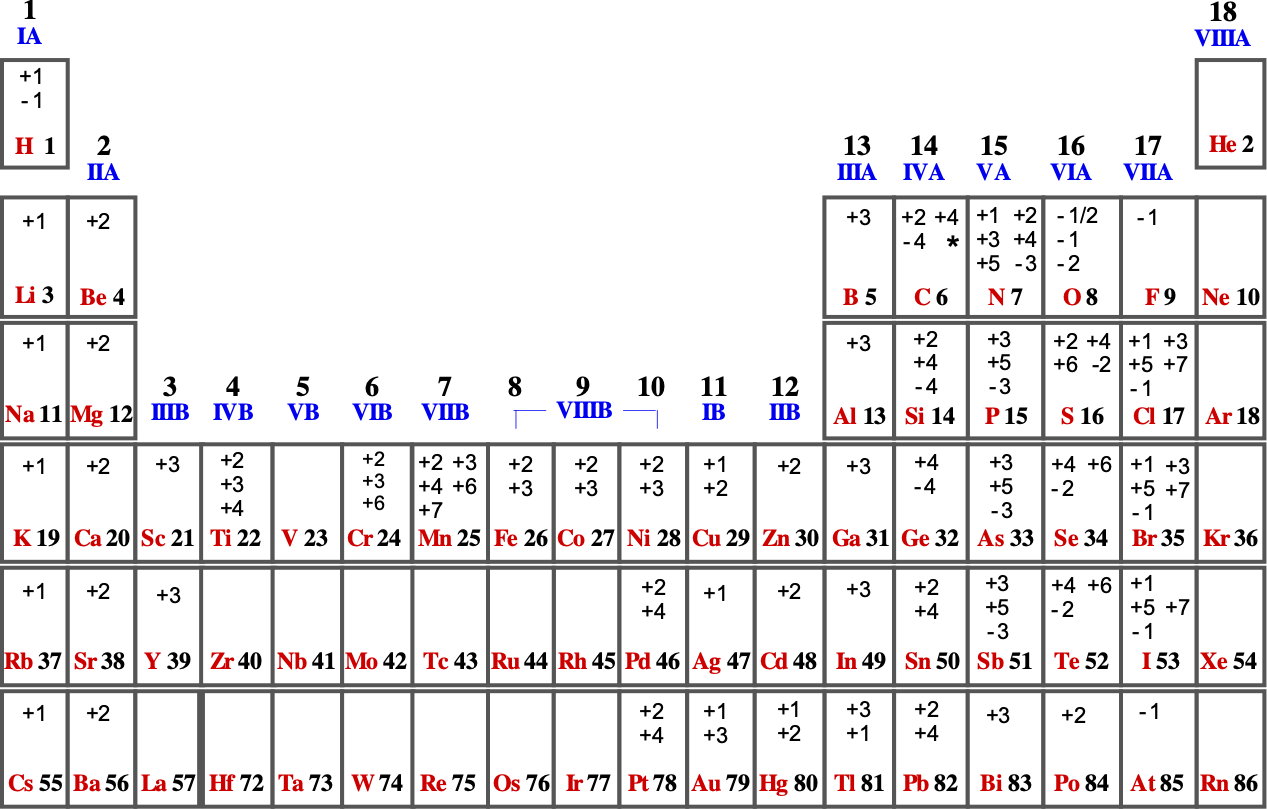
I numeri di ossidazione più comuni di alcuni elementi rappresentativi
OSSIDI
Sono i composti binari tra elemento e ossigeno.
Possono essere sostanze di natura ionica o covalente.
Negli ossidi, l'Ossigeno ha sempre numero di ossidazione (-2) tranne in
di F2O (+2).
Gli ossidi dei non metalli sono quelle sostanze definite anidridi (femminile).
Il termine anidride è obsoleto ed è stato deprecato, ma viene
tuttora utilizzato per alcuni ossidi come ad esempio: CO2 (anidride
carbonica), SO2 (anidride solforosa),
SO3 (anidride solforica).
Ossidi propriamente detti
(ossidi basici) |
|
Anidridi
(ossidi acidi)
|
ELEMENTO METALLICO + Ossigeno |
|
ELEMENTO NON METALLICO + Ossigeno |
Gli ossidi della maggior parte dei metalli hanno proprietà basiche.
Reagendo con l'acqua (talvolta
solo formalmente) generano idrossidi.
Gli ossidi dei metalli del I e del II gruppo hanno caratteristiche spiccatamente ioniche. |
|
Gli ossidi dei non metalli hanno proprietà acide.
La maggior parte di essi, reagendo con l'acqua (talvolta solo formalmente), generano
infatti acidi ossigenati (detti ossiacidi).
Questi ossidi sono sostanze che tipicamente, presentano legami covalenti. |
Alcuni elementi danno ossidi con proprietà anfotere,
ovvero possono avere caratteristiche acide o basiche. La natura acido-base di
un ossido (specialmente di metalli di transizione e di semimetalli) può infatti
variare dal basico all'acido all'aumentare del grado di ossidazione dell'elemento.
Un esempio classico è quello del cromo, il cui ossido è acido
quando il numero di ossidazione è +6, ed è basico o anfotero quando
il numero di ossidazione è +2 (instabile) o +3. Anche il manganese presenta
proprietà simili (vedi al seguente link "tabelle di nomenclatura").
NOMENCLATURA DEGLI OSSIDI
La più vecchia viene detta tradizionale; ricca
di suffissi e prefissi nel caso in cui l'elemento possiede più stati
di ossidazione e, soprattutto, prevede la distinzione tra ossidi e anidridi.
C'è poi la notazione Stock;
se l'elemento possiede più stati di ossidazione, prevede l'utilizzo del
numero di ossidazione scritto in numero romano tra parentesi e senza spazio separatore.
Infine la notazione
razionale IUPAC che impone l'utilizzo
dei prefissi mono-, di-, tri- tetra-, penta- etc. per indicare il numero degli
elementi che compongono l'ossido (il prefisso mono può essere
tralasciato). Viene anche detta "nomenclatura del conto tutto" ma non
distingue tra le proprietà acide o basiche, tra ossidi, perossidi e superossidi.
Le ultime raccomandazioni IUPAC da me lette risalgono al 2004; permettono ed includono
la nomenclatura Stock ed aggiungono anche la possibilità di
indicare, tra parentesi e senza spazio separatore, lo stato di ossidazione con
segno.
Nella tabella che segue ho indicato nella prima parte gli ossidi dei metalli, nella seconda parte gli ossidi dei metalli di transizione e, nella terza parte gli ossidi dei non metalli. In tutti e tre i casi ho seguito l'ordine presente nella tabella periodica. Posizionando il puntatore del mouse sulla formula dell'ossido viene fornita una breve nota sul suo stato fisico. NOTA: alcuni ossidi contengono lo stesso elemento con stati di ossidazione diverso.
Formule e nomi di
ossidi comuni in ordine scondo la tebelle degli elementi
Alcune formule minime non
corrispondono a reali formule molecolari, e talvolta neppure a composti isolabili. |
| Formula |
razionale IUPAC (1) |
Stock |
tradizionale |
n.o. |
| H2O |
ossido di diidrogeno |
ossido di idrogeno |
acqua |
+1 |
| Li2O |
ossido di dilitio |
ossido di litio |
ossido di litio |
+1 |
| Na2O |
ossido di disodio |
ossido di sodio |
ossido di sodio |
+1 |
| K2O |
ossido di dipotassio |
ossido di potassio |
ossido di potassio |
+1 |
| Rb2O |
ossido di dirubidio |
ossido di rubidio |
ossido di rubidio |
+1 |
| Cs2O |
ossido di diicesio |
ossido di cesio |
ossido di cesio |
+1 |
| BeO |
ossido di berillio |
ossido di berillio |
ossido di berillio |
+2 |
| MgO |
ossido di magnesio |
ossido di magnesio |
ossido di magnesio |
+2 |
| CaO |
ossido di calcio |
ossido di calcio |
ossido di calcio |
+2 |
| SrO |
ossido di stronzio |
ossido di stronzio |
ossido di stronzio |
+2 |
| BaO |
ossido di bario |
ossido di bario |
ossido di bario |
+2 |
| Al2O3 |
triossido di dialluminio |
ossido di alluminio |
ossido di alluminio |
+3 |
| Ga2O3 |
triossido di digallio |
ossido di gallio |
ossido di gallio |
+3 |
| SnO |
ossido di stagno |
ossido di stagno(II) |
ossido stannoso |
+2 |
| SnO2 |
diossido di stagno |
ossido di stagno(IV) |
ossido stannico |
+4 |
| PbO |
ossido di piombo |
ossido di piombo(II) |
ossido piomboso |
+2 |
| PbO2 |
diossido di piombo |
ossido di piombo(IV) |
ossido piombico |
+4 |
| Pb3O4 |
Tetrossido di tripiombo |
ossido di piombo(II,IV) |
minio: 2PbO·PbO2 |
|
|
|
OSSIDI DI ALCUNI ELEMENTI DI TRANSIZIONE |
|
|
| FeO |
ossido di ferro |
ossido di ferro(II) |
ossido ferroso |
+2 |
| Fe2O3 |
triossido di diferro |
ossido di ferro(III) |
ossido ferrico |
+3 |
| Fe3O4 |
tetrossido di triferro |
ossido di ferro(II,III) |
magnetite: FeO·Fe2O3 |
|
| CoO |
ossido di cobalto |
ossido di cobalto(II) |
ossido cobaltoso |
+2 |
| Co2O3 |
triossido di dicobalto |
ossido di cobalto(III) |
ossido cobaltico (3) |
+3 |
| Co3O4 |
tetrossido di tricobalto |
ossido di cobalto(II,III) |
CoO·Co2O3 |
|
| NiO |
ossido di nichel |
ossido di nichel(II) |
ossido nicheloso |
+2 |
| Ni2O3 |
triossido di dinichel |
ossido di nichel(III) |
ossido nichelico (2) |
+3 |
| Cu2O |
monossido di dirame |
ossido di rame(I) |
ossido rameoso |
+1 |
| CuO |
ossido di rame |
ossido di rame(II) |
ossido rameico |
+2 |
| CrO |
ossido di cromo |
ossido di cromo(II) |
ossido cromoso |
+2 |
| Cr2O3 |
triossido di dicromo |
ossido di cromo(III) |
ossido cromico |
+3 |
| CrO3 |
triossido di cromo |
ossido di cromo(VI) |
anidride cromica |
+6 |
| MnO |
ossido di manganese |
ossido di manganese(II) |
ossido manganoso |
+2 |
| Mn2O3 |
triossido di dimanganese |
ossido di manganese(III) |
ossido manganico |
+3 |
| Mn3O4 |
tetrossido di trimanganese |
oss. di manganese(II,III) |
MnO·Mn2O3 |
|
| MnO2 |
diossido di manganese |
ossido di manganese(IV) |
diossido di manganese |
+4 |
| Mn2O7 |
eptaossido di manganese |
ossido di manganese(VII) |
anidride permanganica |
+7 |
| ZnO |
ossido di zinco |
ossido di zinco |
ossido di zinco |
+2 |
| Ag2O |
ossido di diargento |
ossido di argento |
ossido di argento |
+1 |
| Hg2O |
ossido di dimercurio |
ossido di mercurio(I) |
ossido mercuroso (2) |
+1 |
| HgO |
ossido di mercurio |
ossido di mercurio(II) |
ossido mercurico |
+2 |
|
| |
OSSIDI DI ALCUNI ELEMENTI NON METALLICI |
|
|
| B2O3 |
triossido di diboro |
ossido di boro(III) |
anidride borica |
+3 |
| CO |
(mon)ossido di carbonio |
ossido di carbonio(II) |
ossido di carbonio |
+2 |
| CO2 |
diossido di carbonio |
ossido di carbonio(IV) |
anidride carbonica |
+4 |
| SiO |
(mon)ossido di silicio |
ossido di silicio(II) |
ossido di silicio |
+2 |
| SiO2 |
diossido di silicio
JSmol view
|
ossido di silicio(IV) |
anidride silicica (silice) |
+4 |
| N2O |
ossido di diazoto |
ossido di azoto(I) |
protossido di azoto
ossido nitroso |
+1 |
| NO |
ossido di azoto |
ossido di azoto(II) |
ossido di azoto
ossido nitrico |
+2 |
| N2O3 |
triossido di diazoto |
ossido di azoto(III) |
anidride nitrosa |
+3 |
NO2
N2O4
|
diossido di azoto monomero
tetrossido di diazoto dimero |
ossido di azoto(IV) |
anidride nitroso-nitrica |
+4 |
| N2O5 |
pentossido di diazoto |
ossido di azoto(V) |
anidride nitrica |
+5 |
| P2O3 |
triossido di difosforo
JSmol view
|
ossido di fosforo(III) |
anidride fosforosa |
+3 |
| P2O5 |
pentossido di difosforo
JSmol view
|
ossdido di fosforo(V) |
anidride fosforica |
+5 |
| As2O3 |
triossido di diarsenico |
ossido di arsenico(III) |
anidride arseniosa |
+3 |
| As2O5 |
pentossido di diarsenico |
ossdido di arsenico(V) |
anidride arsenica |
+5 |
| SO |
ossido di zolfo |
ossido di zolfo(II) |
ossido di zolfo |
+2 |
| SO2 |
diossido di zolfo |
ossido di zolfo(IV) |
anidride solforosa |
+4 |
| SO3 |
triossido di zolfo |
ossido di zolfo(VI) |
anidride solforica |
+6 |
| SeO2 |
diossido di selenio |
ossido di selenio(IV) |
anidride selenosa |
+4 |
| SeO3 |
triossido di selenio |
ossido di selenio(VI) |
anidride selenica |
+6 |
| F2O |
ossido di difluoro |
ossido di fluoro(I) |
anidride fluorica |
-1 |
| Cl2O |
ossido di dicloro |
ossido di cloro(I) |
anidride ipo-clor-osa |
+1 |
| Cl2O3 |
triossido di dicloro |
ossido di cloro(III) |
anidride clor-osa (2) |
+3 |
| Cl2O5 |
pentossido di dicloro |
ossido di cloro(V) |
anidride clor-ica (2) |
+5 |
| Cl2O7 |
eptossido di dicloro |
ossido di cloro(VII) |
anidride per-clor-ica |
+7 |
(1) è corretta la notazione anglofona,
(es. N2O: diazoto monossido).
(2) composti instabili o non isolabili o non facilmente isolabili (vedi
le tabelle di nomenclatura).
(3) preparato in forma mista con il CoO.
Per gli stati di ossidazione del cromo e del manganese vedi la tabella completa di nomenclatura.
| NOTA: gli ossidi di azoto, in inglese, assumono nomi la cui traduzione dei primi due è curiosa |
| N2O |
nitrous oxide |
| NO |
nitric oxide |
| N2O3 |
dinitrogen trioxide |
| NO2 |
nitrogen dioxide (il dimero N2O4 : dinitrogen tetroxide) |
| N2O5 |
dinitrogen pentoxide |
Perossidi
Sono i composti contenenti il gruppo perossido
(-O-O-) che presenta un legame singolo tra due atomi di ossigeno.
Nei perossidi, l'ossigeno (bivalente) ha numero di ossidazione (-1).
Possono essere sostanze covalenti (ad esempio, perossido
di idrogeno o acqua ossigenata, H2O2)
o ioniche (con i metalli, ad esempio, perossido di sodio, Na2O2,
perossido di calcio, CaO2); in questi ultimi, il gruppo perossido è ovviamente
presente in forma ionica: O22-
La nomenclatura IUPAC permette di chiamarli esattamente come gli ossidi. Noi
li chiameremo perossidi o useremo il nome corrente.
Superossidi
Sono generalmente composti ionici contenenti
lo ione radicale superossido: (O2-) del quale abbiamo già studiato
il riempimento degli orbitali molecolari.
Nei superossidi, l'Ossigeno ha numero di ossidazione (-1/2).
La nomenclatura IUPAC permette di chiamarli esattamente come gli ossidi.
Noi li chiameremo superossidi o useremo il nome corrente.
Idrossidi
Sono composti ternari formati da IDROGENO, OSSIGENO
e un metallo
Si possono considerare derivati formalmente della reazione tra un ossido basico
(metallo-ossigeno) e l'acqua. Ho aggiunto "formalmente" perché in
molti casi la reazione nella pratica non avviene e l'idrossido viene ottenuto per
altra via.
Si scrivono premettendo il metallo seguito da tanti gruppi OH quanto è la
valenza del metallo, secondo lo schema M(OH)n, metallo - ione
idrossido. Si possono definire come composti
formati da un metallo e ioni OH- (idrossido; il termine ossidrile
è obsoleto) allo
scopo di metterne in evidenza la natura ionica e basica anche se spesso la loro struttura può essere diversa in funzione del metallo. Così, ad esempio, le specie che possiamo indicare come Fe(OH)3 o Pb(OH)2, sono in realtà composti più complessi (approfondimenti di Chimica Inorganica).
Esempi:
Na2O + H2O  2 NaOH 2 NaOH
CaO + H2O  Ca(OH)2 Ca(OH)2
Al2O3 + 3 H2O
 2 Al(OH)3 (reazione
formale) 2 Al(OH)3 (reazione
formale)
Nella tabella che segue posizionando il puntatore del mouse sulla formula dell'idrossido viene fornita una breve nota sul suo stato fisico.
| Formule e nomi di
idrossidi comuni |
| Formula |
razionale IUPAC (*) |
Stock |
tradizionale |
n.o. |
| LiOH |
idrossido di litio |
idrossido di litio |
idrossido di litio |
+1 |
| NaOH |
idrossido di sodio |
Idrossido di sodio |
Idrossido di sodio
(soda caustica) |
+1 |
| KOH |
idrossido di potassio |
idrossido di potassio |
idrossido di potassio
(potassa caustica) |
+1 |
| Mg(OH)2 |
diidrossido di magnesio |
idrossido di magnesio |
idrossido di magnesio |
+2 |
| Ca(OH)2 |
diidrossido di calcio |
idrossido di calcio |
idrossido di calcio |
+2 |
| Ba(OH)2 |
diidrossido di bario |
idrossido di bario |
idrossido di bario |
+2 |
| Al(OH)3 |
triidrossido di alluminio |
idrossido di alluminio |
idrossido di alluminio |
+3 |
| Zn(OH)2 |
diidrossido di zinco |
idrossido di zinco |
idrossido di zinco |
+2 |
| Fe(OH)2 |
diidrossido di ferro |
idrossido di ferro(II) |
idrossido ferroso |
+2 |
| Fe(OH)3 |
triidrossido di ferro |
idrossido di ferro(III) |
idrossido ferrico |
+3 |
| Sn(OH)2 |
diidrossido di stagno |
idrossido di stagno(II) |
idrossido stannoso |
+2 |
| Sn(OH)4 |
tetraidrossido di stagno |
idrossido di stagno(IV) |
idrossido stannico |
+4 |
(*) è corretta la notazione anglofona,
(es. Fe(OH)3: ferro triidrossido).
NOTE:
Gli idrossidi dei metalli alcalini (gruppo I) sono tipiche basi forti.
Gli idrossidi dei metalli alcalino-terrosi (gruppo II) sono basi forti ma poco
solubili.
Idrossidi come Al(OH)3 o Zn(OH)2 e altri hanno
un comportamento anfotero.
|
