Calcolo del pH delle soluzioni acquose (2a parte)
Una soluzione tampone a pH circa 7
Per realizzare un tampone a pH=7 è necessario utilizzare un
acido debole con un pKa prossimo a tale valore (pKa = - log Ka).
Un acido debole con valore di Ka adeguato è il diidrogeno-fosfato,
corrispondente alla seconda dissociazione dell'acido ortofosforico:
H3PO4 (aq) + H2O(l)
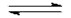 H2PO4-(aq) + H3O+(aq)
H2PO4-(aq) + H3O+(aq) |
Ka1 = 7.5x10-3 |
pKa1 = 2.12 |
H2PO4-(aq) + H2O(l)
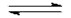 HPO42-(aq) + H3O+(aq)
HPO42-(aq) + H3O+(aq) |
Ka2 = 6.2x10-8 |
pKa2 = 7.21 |
HPO42-(aq) + H2O(l)
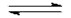 PO43-(aq) + H3O+(aq)
PO43-(aq) + H3O+(aq) |
Ka3 = 4.8x10-13 |
pKa3 = 12.32 |
La base coniugata corrispondente allo ione diidrogeno-fosfato è
lo ione monoidrogeno-fosfato. Per introdurre in soluzione lo ione diidrogeno-fosfato
può essere utilizzato un sale che lo contiene come anione (es. NaH2PO4 oppure
KH2PO4). Lo stesso si può fare per
lo ione monoidrogeno-fosfato (es. Na2HPO4 oppure
KH2PO4).
Avremo quindi la possibilità di realizzare una soluzione tampone per mezzo
dei due sali:
(NaH2PO4) che funge da acido attraverso lo ione H2PO4-
(Na2HPO4) che funge da sale (base coniugata) attraverso lo
ione HPO42-.
L'espressione per il calcolo del
pH sarà quella generale nella quale l'acido sarà il diidrogeno-fosfato
e la base coniugata il monoidrogeno-fosfato e la Ka dell'acido sarà la Ka2
dell'acido ortofosforico.
Nel caso in cui il rapporto tra acido e base coniugata risulta unitario,
il pH del tampone sarà:
- log [H3O+] = - log Ka2 = 7.2
Reazione di un acido con una base
Nella reazione che si verifica tra un acido con una base in soluzione, il
pH risultante dipende sia dalle quantità relative
delle due sostanze che dal tipo di acido e base utilizzati. Nella nostra
trattazione, per semplificare quanto più possibile l'argomento,
non prenderemo in considerazione la reazione di un acido con una
base entrambi deboli.
NOTA: le quantità delle
sostanze che caratterizzano il pH delle miscele risultanti a fine reazione,
sono indicate in rosso.
Reazione di un acido forte con una base forte (in soluzione)
Si supponga di far reagire acido nitrico
con idrossido di sodio e che siano note le quantità, espresse
in moli o millimoli, delle sostanze reagenti. Consideriamo tre casi
principali (Si noti che le quantità utilizzate nell'esempio sono
puramente indicative):
a) eccesso di acido (10 millimoli di acido
+ 4 millimoli di base)
b) quantità equivalenti (10 millimoli
di acido + 10 millimoli di base)
c) eccesso di base (10 millimoli di acido +
11 millimoli di base)
Gli schemi utili per una chiara comprensione, sono di seguito visualizzati.
Nella prima linea vengono indicate le quantità iniziali, nella
seconda quelle che reagiscono, nella terza quelle che si formano e,
infine, le quantità delle sostanze che rimangono in soluzione
a fine reazione. Con un poco di esperienza, e per brevità, i
due passaggi intermedi possono essere fatti a mente.
Si tenga presente che la quantità che
reagisce effettivamente è data dalla quantità minore (reagente
limitante).
caso a: il
pH è dovuto all'eccesso di acido forte e va calcolato dalla concentrazione
molare di tale eccesso
| |
HNO3 |
+ |
NaOH |
 |
NaNO3 |
+ |
H2O |
| iniziali |
10 |
|
4 |
|
|
|
|
| reagiscono |
4 |
|
4 |
|
|
|
|
| si formano |
|
|
|
|
4 |
|
4 |
| fine reazione |
6 |
|
- |
|
4 |
|
4 |
caso b: il pH è 7:
il sale fomato non subisce idrolisi
| |
HNO3 |
+ |
NaOH |
 |
NaNO3 |
+ |
H2O |
| iniziali |
10 |
|
10 |
|
|
|
|
| reagiscono |
10 |
|
10 |
|
|
|
|
| si formano |
|
|
|
|
10 |
|
10 |
| fine reazione |
- |
|
- |
|
10 |
|
10 |
caso c: il pH è dovuto
all'eccesso di base forte e va calcolato dalla concentrazione molare
di tale eccesso
| |
HNO3 |
+ |
NaOH |
 |
NaNO3 |
+ |
H2O |
| iniziali |
10 |
|
11 |
|
|
|
|
| reagiscono |
10 |
|
10 |
|
|
|
|
| si formano |
|
|
|
|
10 |
|
10 |
| fine reazione |
- |
|
1 |
|
10 |
|
10 |
TITOLAZIONE di una soluz. di acido FORTE con una base FORTE
Per titolazione si intende l'aggiunta molto graduale di
un reagente ad una soluzione contenente una certa sostanza chimica e il contemporaneo
monitoraggio del processo mediante la misura di una grandezza chimico-fisica dipendente
dalle variazioni apportate al sistema. Nelle titolazioni acido-base classiche si
aggiunge un acido ad una base (o viceversa) e si misura, ad esempio, il pH con un
piaccametro o la conducibilità elettrolitica
con un "ponte di conducibilità".
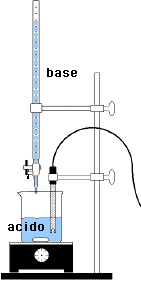 La titolazione di un acido forte con una base forte è l'esempio
più semplice di titolazione acido-base. Come già illustrato nei riquadri
precedenti, il pH di una reazione di questo tipo si può calcolare tenendo
conto dell'eccesso di uno dei due reagenti e considerando il pH come il logaritmo
negativo della concentrazione dell'eccesso. Nell'esempio che segue supponiamo di
porre in un contenitore (beker) 100 mL di acido forte 0.1 M (HCl) e di disporre
di una buretta con la possibilità di dispensare, nello stesso contenitore,
il volume da noi desiderato di una base forte 0.1 M (NaOH). La curva dei valori
di pH in funzione dei mL di base aggiunta può
essere determinata teoricamente calcolando il pH dopo una certa serie numerosa di
piccole aggiunte con lo scopo di ottenere una curva praticamente continua. Nel nostro
esempio ci limitiamo a una decina di calcoli che ci daranno comunque l'idea di come
varia il pH durante la titolazione. Pur non tenendo conto dell'effettiva attività della
concentrazione idrogenionica, la curva teorica determinata è una
valida approssimazione del processo sperimentale.
La titolazione di un acido forte con una base forte è l'esempio
più semplice di titolazione acido-base. Come già illustrato nei riquadri
precedenti, il pH di una reazione di questo tipo si può calcolare tenendo
conto dell'eccesso di uno dei due reagenti e considerando il pH come il logaritmo
negativo della concentrazione dell'eccesso. Nell'esempio che segue supponiamo di
porre in un contenitore (beker) 100 mL di acido forte 0.1 M (HCl) e di disporre
di una buretta con la possibilità di dispensare, nello stesso contenitore,
il volume da noi desiderato di una base forte 0.1 M (NaOH). La curva dei valori
di pH in funzione dei mL di base aggiunta può
essere determinata teoricamente calcolando il pH dopo una certa serie numerosa di
piccole aggiunte con lo scopo di ottenere una curva praticamente continua. Nel nostro
esempio ci limitiamo a una decina di calcoli che ci daranno comunque l'idea di come
varia il pH durante la titolazione. Pur non tenendo conto dell'effettiva attività della
concentrazione idrogenionica, la curva teorica determinata è una
valida approssimazione del processo sperimentale.
I calcoli sono riportati nella tabella che segue, in cui figurano nell'ordine:
| |
| (a) |
le aggiunte complessive di NaOH (in mL) |
| (b) |
il volume della soluzione dopo le aggiunte (in mL) |
| (c) |
il numero di mmoli di base aggiunta |
| (d) |
il numero di mmoli di base forte rimaste (solo dopo il punto di equivalenza) |
| (e) |
il numero di mmoli in eccesso di acido forte (fino al punto di equivalenza) |
| (f) |
la concentrazione di [H3O+] calcolata come [HCl residuo]
/ (V soluz.). Quando viene superato il punto di
equivalenza [H3O+] = Kw / [OH - ]. |
| (g) |
il pH della soluzione calcolato come pH = - log [H3O+]
|
V aggiunto
di NaOH |
V soluz. |
mmoli agg.
di NaOH |
mmoli
di NaOH)
residui
|
mmoli
di HCl
residui
|
[H3O+] |
pH |
| 0 |
100 |
- |
- |
10 |
0.1 |
1.0 |
| 10 |
110 |
1 |
- |
9 |
8.18.10-2 |
1.09 |
| 20 |
120 |
2 |
- |
8 |
6.67.10-2 |
1.17 |
| 50 |
150 |
5 |
- |
5 |
3.33.10-2 |
1.48 |
| 70 |
170 |
7 |
- |
3 |
1.76.10-2 |
1.75 |
| 90 |
190 |
9 |
- |
1 |
5.26.10-3 |
2.28 |
| 99.5 |
199.5 |
9.95 |
- |
0.05 |
2.50.10-4 |
3.6 |
| 99.9 |
199.9 |
8.99 |
- |
0.01 |
5.0.10-5 |
4.3 |
| 100 |
200 |
10 |
- |
- |
1.0.10-7 |
7.0 |
| 100.5 |
200.5 |
10.05 |
0.05 |
|
4.01.10-11 |
10.4 |
| 110 |
210 |
11 |
1 |
|
2.10.10-12 |
11.68 |
|
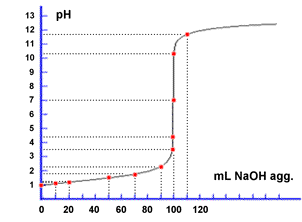 Sulla
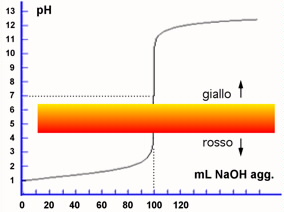
destra viene riportata la curva di titolazione simulata in continuo e i punti
calcolati alle specifiche aggiunte di titolante riportati in tabella. Si osservi
la graduale variazione fino ad arrivare nelle vicinanze del punto di equivalenza.
Ad un certo punto il pH varia rapidamente per poi impennarsi con pendenza
elevatissima esattamente nell'intorno del P.E. Questo "salto" di
pH viene sfruttato per effettuare titolazioni senza l'ausilio di particolari
strumenti di registrazione del pH. In questi casi
lo scopo delle titolazioni è quello di determinare la concentrazione di
una soluzione a titolo incognito attraverso l'esatta individuazione del punto
di equivalenza. Il punto di equivalenza viene "visualizzato" grazie
a particolari sostanze coloranti, dette "indicatori
di pH", che hanno
la proprietà di
cambiare decisamente di colore se il pH sbalza di circa 2 unità nell'intorno
di particolari valori (pKind) tipici
di ogni specifico indicatore. Scegliendo l'indicatore giusto, appena si raggiunge
il P.E. la repentina variazione di colore dell'indicatore informa l'operatore
che il numero di equivalenti di titolante aggiunti ha uguagliato quelli presenti
nel campione in esame. Sulla
destra viene riportata la curva di titolazione simulata in continuo e i punti
calcolati alle specifiche aggiunte di titolante riportati in tabella. Si osservi
la graduale variazione fino ad arrivare nelle vicinanze del punto di equivalenza.
Ad un certo punto il pH varia rapidamente per poi impennarsi con pendenza
elevatissima esattamente nell'intorno del P.E. Questo "salto" di
pH viene sfruttato per effettuare titolazioni senza l'ausilio di particolari
strumenti di registrazione del pH. In questi casi
lo scopo delle titolazioni è quello di determinare la concentrazione di
una soluzione a titolo incognito attraverso l'esatta individuazione del punto
di equivalenza. Il punto di equivalenza viene "visualizzato" grazie
a particolari sostanze coloranti, dette "indicatori
di pH", che hanno
la proprietà di
cambiare decisamente di colore se il pH sbalza di circa 2 unità nell'intorno
di particolari valori (pKind) tipici
di ogni specifico indicatore. Scegliendo l'indicatore giusto, appena si raggiunge
il P.E. la repentina variazione di colore dell'indicatore informa l'operatore
che il numero di equivalenti di titolante aggiunti ha uguagliato quelli presenti
nel campione in esame.
Gli INDICATORI di pH e le costanti apparenti.
Gli indicatori di pH sono acidi o basi di natura organica.
Sono caratterizzati dal fatto che la forma dissociata e quella indissociata assumono
in soluzione colorazioni vistosamente diverse e normalmente molto intense. Quest'ultima
affermazione significa che il nostro sistema visivo è in grado di rilevare
piccole quantità di tali sostanze percependone chiaramente il colore e le
sue eventuali variazioni. L'elevata intensità prodotta dal queste sostanze ne permette
l'uso in piccolissime quantità in modo tale
da non modificare le condizioni ambientali del sistema in cui vengono introdotte.
Nelle classiche titolazioni acido-base, vengono aggiunte modestissime quantità di
indicatore ed Il pH del sistema, pertanto, non dipenderà quasi per nulla dalla presenza
dell'indicatore.
Indichiamo con HInd un generico
acido organico indicatore e supponiamo che abbia una costante acida Ka = 1.0×10-5 (pKind = 5). Ammettiamo che abbia il colore "A" nella forma indissociata ed il colore "B" quando è nella
forma di base coniugata:
col.(A) |
|
|
col.(B) |
| HInd(aq) |
+ H2O(l) |
H3O+(aq) + |
Ind -(aq) |
La costante di equilibrio di questo acido debole avrà la seguente espressione
Se la sostanza si trova in soluzione da sola, può essere trattata come
un normalissimo acido debole: avrà un grado di dissociazione che sarà funzione
della sua costante di equilibrio e dipenderà
anche dalla concentrazione. Il colore che un
osservatore "vede" dipende dal grado di dissociazione, perchè da
questo dipende il rapporto di concentrazione delle sostanze
HInd e Ind -.
La prevalenza rilevante di una delle due sostanze rispetto all'altra determina
la sensazione di un unico colore o "A" oppure "B".
Consideriamo i tre seguenti casi:
| |
a) il pH del sistema è pH = - log [H3O+] = - log [10-4] = 4 (di una unità inferiore
al pKind)
b) il pH del sistema è pH = - log [H3O+] = - log [10-5] = 5 (uguale al pKind)
c) il pH del sistema è pH = - log [H3O+] = - log [10-6] = 6 (di una unità superiore
al pKind).
|
a) Il valore di [H3O+] è determinato
dal sistema, pertanto la costante di equilibrio può inglobare questo termine:
Il valore ottenuto inglobando il termine [H3O+], viene
chiamato costante apparente:
Sostituiamo i valori noti di costante e concentrazione degli ioni idronio:
Il valore ottenuto indica che a pH = 4, inferiore di una unità rispetto
al pK dell'indicatore, l'equilibrio dello stesso viene spostato verso sinistra
di una quantità tale che la concentrazione della base coniugata
Ind - risulta
10 volte minore rispetto all'acido presente in forma indissociata.
In queste condizioni il nostro acido indicatore risulterà dissociato per
meno del 10%. Un osservatore normale dirà che il colore della soluzione è "A".
Il colore "B" dovuto ad Ind - è completamente
mascherato dal colore "A" dovuto a HInd perchè questa
specie prevale nettamente in termini di concentrazione. Supponendo di avere posto
in soluzione 11 micromoli di indicatore, avremmo:
col.(A) |
|
|
col.(B) |
| HInd(aq) |
+ H2O(l) |
H3O+(aq) + |
Ind -(aq) |
| 10 |
|
|
1 |
|
b) Il valore della costante apparente, in queste condizioni sarà:
Il valore ottenuto indica che a pH = 5, uguale al pK dell'indicatore,
l'equilibrio dello stesso risulta bilanciato al punto che la concentrazione
della base coniugata risulta uguale a quella dell'acido presente in forma
indissociata.
In queste condizioni il nostro acido indicatore risulterà dissociato per
il 50%. Un osservatore normale dirà che il colore della soluzione è quello
intermedio tra "A" e "B".
col.(A) |
|
|
col.(B) |
| HInd(aq) |
+ H2O(l) |
H3O+(aq) + |
Ind -(aq) |
| 5.5 |
|
|
5.5 |
|
c) Il valore della costante apparente, in queste condizioni sarà:
Il valore ottenuto indica che a pH = 6, superiore di una unità rispetto
al pK dell'indicatore, l'equilibrio dello stesso viene spostato verso destra
di una quantità tale che la concentrazione della base coniugata
Ind -
risulta 10 volte superiore rispetto all'acido presente in forma indissociata.
In queste condizioni il nostro acido indicatore risulterà dissociato per
oltre il 90%. Un osservatore normale dirà che il colore della soluzione è quello
(B). Il colore (A) dovuto ad HInd è completamente
mascherato dal colore (B) dovuto a Ind - perchè questa
specie prevale nettamente in termini di concentrazione.
col.(A) |
|
|
col.(B) |
| HInd(aq) |
+ H2O(l) |
H3O+(aq) + |
Ind -(aq) |
| 1 |
|
|
10 |
|
Un indicatore con pK = 5 esiste veramente ed è il Rosso Metile. Questo
indicatore presenta un intervallo di viraggio approssimativamente tra 4.4 e 6.2.
Pur non essendo l'ideale, può essere utilizzato per indicarci il punto equivalente
di una titolazione Acido forte - Base forte con valori di concentrazione non inferiori di circa 0.1 molare.
Nel momento in cui viene raggiunto il P.E l'indicatore "vira" dal rosso al giallo
se la titolazione viene condotta nel senso indicato dal grafico (aggiunta di NaOH
ad un acido forte).
SULLE COSTANTI APPARENTI
Abbiamo già definito le costanti apparenti parlando di indicatori. Ripetiamo
il discorso utilizzando un acido debole tipico con Ka = 1.0×10-5 (pKa =
5). Vale quanto segue:
| HA(aq) |
+ H2O(l) |
H3O+(aq) + |
A -(aq) |
Se il nostro acido debole è presente in quantità piccole o se l'ambiente è costituito
da un sistema tampone sufficientemente concentrato ed efficace, la sua presenza non
influenzerà il
pH ed il valore della concentrazione protonica (di ioni idronio) sarà quello del sistema. [H3O+] può essere
inglobato nella costante di equilibrio dell'acido debole. Il rapporto che ne deriva
è la
costante apparente dell'acido:
Se ipotizziamo la presenza di un sistema tampone a pH = 7, potremo scrivere:
Si osserva una costante apparente di valore molto elevato. L'entità della
dissociazione dell'acido risulta quella che avrebbe qualora la sua costante di dissociazione
avesse il valore della costante apparente. Nelle nostre condizioni la quantità di
acido dissociato risulta pari al 99%, comportandosi da acido forte. Questo discorso
vale per qualunque specie chimica acida o basica soggetta all'azione tamponante dell'ambiente.
il DNA, ad esempio, in ambiente tamponato a pH neutro, presenta i gruppi fosfato
totalmente dissociati (k=10-3);
l'ATP, nelle stesse condizioni, si presenta con 3 protoni totalmente dissociati e
deprotonato per il 47% per quanto riguarda il secondo protone legato all'ultimo fosfato
esterno.
|

 Sulla
destra viene riportata la curva di titolazione simulata in continuo e i punti
calcolati alle specifiche aggiunte di titolante riportati in tabella. Si osservi
la graduale variazione fino ad arrivare nelle vicinanze del punto di equivalenza.
Ad un certo punto il pH varia rapidamente per poi impennarsi con pendenza
elevatissima esattamente nell'intorno del P.E. Questo "salto" di
pH viene sfruttato per effettuare titolazioni senza l'ausilio di particolari
strumenti di registrazione del pH. In questi casi
lo scopo delle titolazioni è quello di determinare la concentrazione di
una soluzione a titolo incognito attraverso l'esatta individuazione del punto
di equivalenza. Il punto di equivalenza viene "visualizzato" grazie
a particolari sostanze coloranti, dette "indicatori
di pH", che hanno
la proprietà di
cambiare decisamente di colore se il pH sbalza di circa 2 unità nell'intorno
di particolari valori (pKind) tipici
di ogni specifico indicatore. Scegliendo l'indicatore giusto, appena si raggiunge
il P.E. la repentina variazione di colore dell'indicatore informa l'operatore
che il numero di equivalenti di titolante aggiunti ha uguagliato quelli presenti
nel campione in esame.
Sulla
destra viene riportata la curva di titolazione simulata in continuo e i punti
calcolati alle specifiche aggiunte di titolante riportati in tabella. Si osservi
la graduale variazione fino ad arrivare nelle vicinanze del punto di equivalenza.
Ad un certo punto il pH varia rapidamente per poi impennarsi con pendenza
elevatissima esattamente nell'intorno del P.E. Questo "salto" di
pH viene sfruttato per effettuare titolazioni senza l'ausilio di particolari
strumenti di registrazione del pH. In questi casi
lo scopo delle titolazioni è quello di determinare la concentrazione di
una soluzione a titolo incognito attraverso l'esatta individuazione del punto
di equivalenza. Il punto di equivalenza viene "visualizzato" grazie
a particolari sostanze coloranti, dette "indicatori
di pH", che hanno
la proprietà di
cambiare decisamente di colore se il pH sbalza di circa 2 unità nell'intorno
di particolari valori (pKind) tipici
di ogni specifico indicatore. Scegliendo l'indicatore giusto, appena si raggiunge
il P.E. la repentina variazione di colore dell'indicatore informa l'operatore
che il numero di equivalenti di titolante aggiunti ha uguagliato quelli presenti
nel campione in esame.