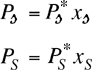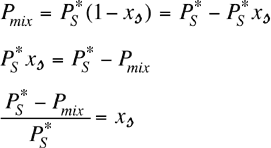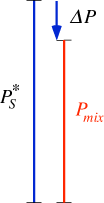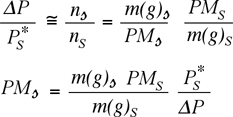La tensione di vapore
Si immagini di inserire un certo quantitativo di acqua in un contenitore e di chiuderlo immediatamente in modo ermetico e di avere tutto il sistema perfettamente termostatato alla temperatura di 25 °C. Nelle immagini che seguono l'acqua e il suo vapore sono volutamente colorate in modo eccessivo solo per avere un maggiore effetto visivo.
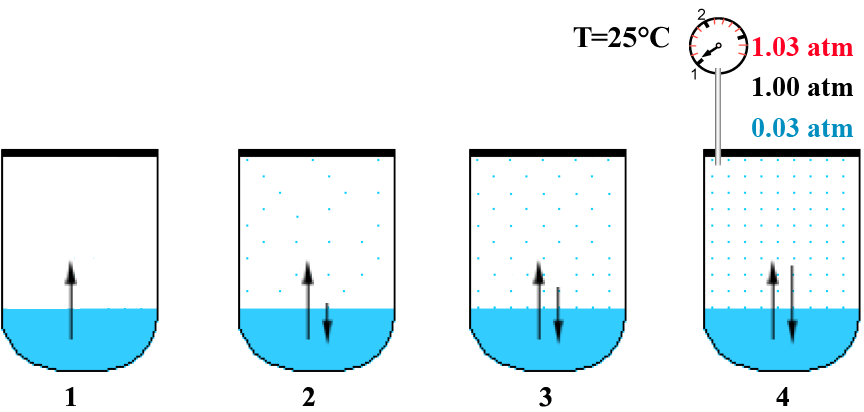
Subito dopo la chiusura del contenitore, al suo interno sono presenti l'acqua liquida e l'aria rimasta intrappolata (ovviamente invisibile in fig. 1). Con il passare del tempo le molecole più energetiche del liquido vincono la tensione superficiale e riescono a passare nella fase vapore (normale fenomeno di evaporazione "freccia verso l'alto") (figure 1 e 2). Quando un buon numero di molecole di acqua sono ormai evaporate, statisticamente un certo numero di esse può ricondensare, cioè ritornare verso la fase liquida ("freccia verso il basso"). Fintantoché il numero di molecole presenti nella fase vapore non è sufficientemente numeroso, prevarrà il processo di evaporazione rispetto a quello di ricondensazione; si intuisce che ad un certo punto i due processi assumeranno la stessa rapidità (i due vettori avranno la stessa intensità") (figure 2, 3 e 4). Da questo momento in poi, se la temperatura di mantiene costante, il sistema liquido-vapore ha raggiunto il suo equilibrio e la pressione dovuta alle molecole di acqua in fase vapore si chiama tensione o pressione di vapore. Nella figura 4 potete notare che la misura della pressione della fase aeriforme (in rosso) risulta pari a 1.03 atmosfere ed è la risultante della somma di quella relativa alla pressione del vapore acqueo (in blu) e di quella dovuta all'aria rimasta intrappolata nel contenitore (in nero).
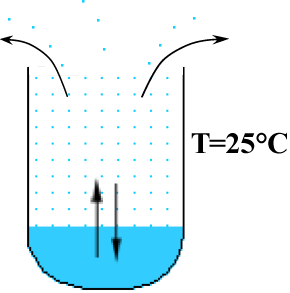 |
Se il contenitore viene aperto, le molecole di acqua presenti nella fase gassosa tenderanno a diffondere verso l'esterno, anche sospinte dai movimenti termici dell'aria circostante il contenitore; verranno soppiantate da altre molecole che evaporano. Nel tempo, anche a 25 °C l'acqua potrà evaporare completamente e la rapidità del fenomeno dipenderà dalla temperatura e dalla superficie esposta all'aria. |
Se si aumenta la temperatura del nostro sistema chiuso, si favorirà il fenomeno dell'evaporazione e l'equilibrio verrà raggiunto con una maggiore quantità di vapore (equilibrio spostato verso la fase vapore) cioè si avrà un aumento della tensione di vapore. Nella figura seguente viene rappresenato quanto detto considerando la fase gassosa avente comportamento ideale.
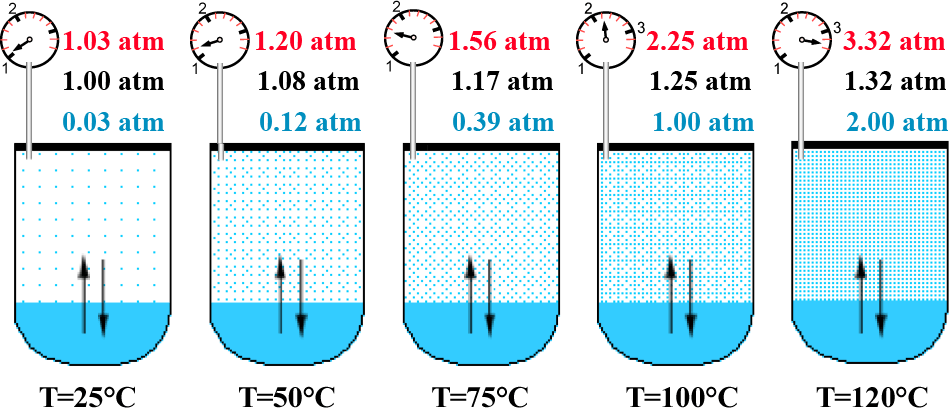
Si noti che l'acqua (il liquido che abbiamo preso in considerazione) non va all'ebollizione anche a temperature superiori a 100 °C perché la sua tensione di vapore non riesce mai a superare la pressione sovrastante il liquido. Un liquido bolle alla temperatura in cui la sua tensione di vapore raggiunge la pressione sovrastante. Se il contenitore viene aperto, la pressione esterna assume il valore di 1 atm e l'acqua bollirà a 100 °C. Nel diagramma di fase in scala dell'acqua illustrato nel lucido_19b vengono indicate le temperature di ebollizione a diverse altezze sul livello del mare per evidenziare che la temperatura di ebollizione nei sistemi aperti dipende anche dalla pressione esterna.
La tensione di vapore e la legge di François-Marie Raoult
La tensione di vapore di una miscela ideale di due solventi è la somma dei contributi di ciascun componente la miscela. Ogni componente fornisce un contributo parziale pari alla percentuale con cui partecipa alla miscela stessa (ovvero la sua frazione molare).
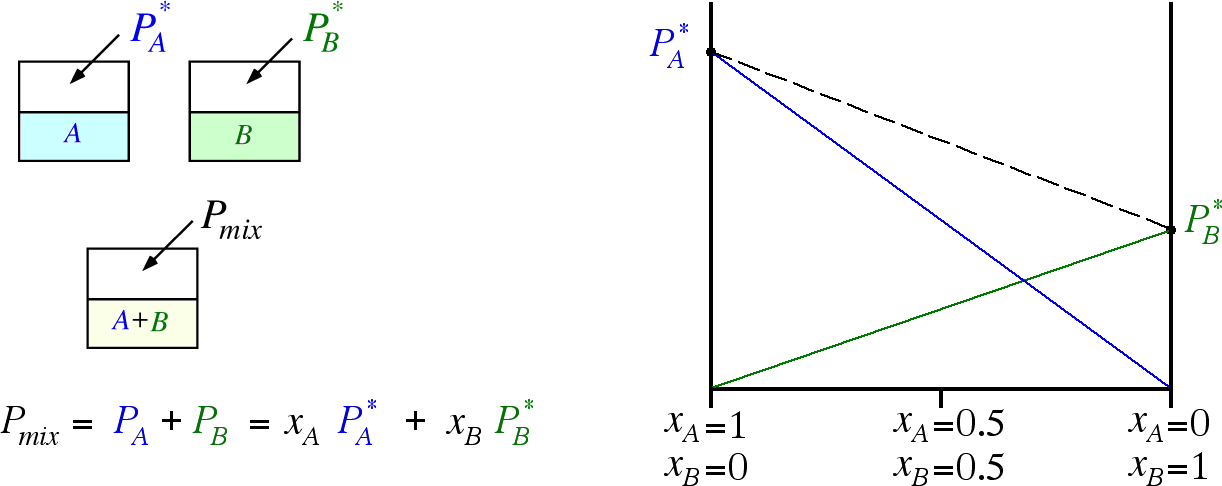
Consideriamo una miscela (soluto non volatile-Solvente) e indichiamo con:
= tensione di vapore del soluto puro = tensione di vapore del Solvente puro = tensione di vapore parziale del soluto in miscela con il Solvente = tensione di vapore parziale del Solvente in miscela con il soluto = frazione molare del soluto = frazione molare del solvente
La tensione di vapore parziale di ciascun componente è proporzionale alla sua frazione molare:
La tensione di vapore Pmix della soluzione è la somma dei due contributi parziali, idealmente:
Nel caso in cui il soluto è praticamente non volatile ed è presente in basse concentrazioni (soluzione diluita), il suo contributo alla tensione di vapore può essere trascurato e pertanto la tensione di vapore della soluzione sarà quella parziale del solvente:
poiché: ![]() ,
risulta
,
risulta ![]() .
Sostituendola nella precedente:
.
Sostituendola nella precedente:
L'abbassamento relativo della tensione di
vapore di una soluzione diluita (quasi ideale) di un soluto non volatile è uguale alla
frazione molare del soluto. |
|
L'abbassamento relativo della tensione di vapore è una proprietà colligativa perchè è funzione della concentrazione delle particelle chimiche estranee al solvente e non dipende dalla loro natura o identità chimica; queste particelle derivano dalla o dalle sostanze che si solubilizzano nel solvente. Il numero di particelle "estranee" prodotte da una certa quantità di un determinato composto chimico che viene solulbilizzzato puņ dipendere dalla sua natura e dall'interazione con il solvente.
Determinazione del Peso Molecolare
Dalla legge di Raoult per soluti non volatili
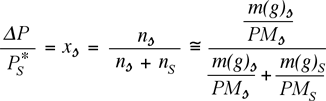
Pertanto, nota la composizione fisica della soluzione, il PM e la tensione di vapore del solvente, e misurato l'abbassaento della tensione di vapore, l'unica incognita rimane il PM del soluto.
Per soluzioni diluite in cui
si può scrivere:
da cui: