Legami chimici
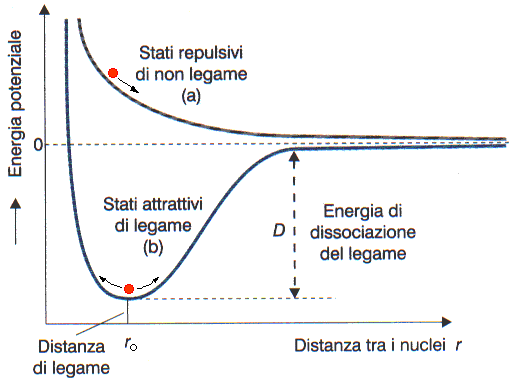
Possibilità di legame e di non legame per due atomi che si avvicinano (profilo energetico):
Legame ionico
Il legame ionico è un legame di natura prettamente elettrostatica e si forma quando si combinano fra di loro due elemeni aventi, rispettivamente, un basso potenziale di ionizzazione (elemento metallico elettropositivo) e una elevata affinità per l'elettrone (elemento non metallico: a destra nella tabella periodica).
Nei casi semplici, es. NaCl, CsCl etc, gli atomi ionizzati (Na+ e Cl-) tendono ad attrarsi elettrostaticamente. Tenendo conto che 4πε0=1.112×10−10 C2(J m) e che le cariche in gioco sono pari alla carica dell'elettrone (e=1.6022×10−19 C), il profilo energetico per una signola coppia di ioni è dettato dalla seguente espressione derivata dalla legge di Coulomb:
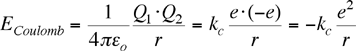
L'energia di interazione elettrostatica, pertanto, risulta proporzionale al prodotto delle cariche elettriche ed è inversamente proporzionale alla loro distanza. Il segno negativo indica che due cariche opposte tendono ad attirarsi. Il profilo grafico è rappresentato da un ramo di iperbole nel quarto quadrante continuamente decrescente man mano che la distanza tra i nuclei (r) diminuisce. Secondo questo andamento i due ioni dovrebbero tosto andare a contatto e quindi scaricarsi.
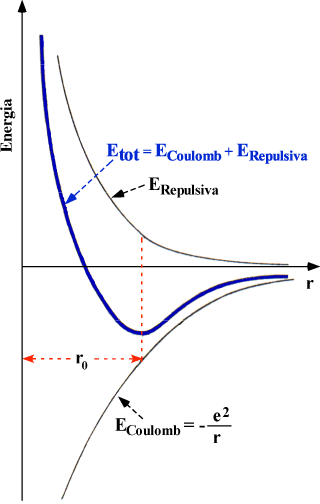
In realtà, quando i mantelli elettronici esterni dei due ioni sono sufficientemente vicini, essi interagiscono fortemente producendo un effetto repulsivo (si veda la curva: curva ER).
Il risultato complessivo è una curva di potenziale tipica dei sistemi leganti con un minimo intorno alla distanza media di legame (curva più spessa in blul nel grafico seguente):
 |
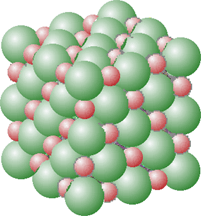
I solidi ionici sono caratterizzati dalle cosiddette molecole giganti, ovvero la loro struttura macroscopica é ottentuta da un numero enorme di ioni disposti ordinatamente nel reticolo cristallino. Tale struttura rende condo della loro durezza, fragilità, dell'elevata temperatura di fusione. Generalmente sono solubili in solventi polari ad elevata costante dielettrica (es. acqua).
Il reticolo cristallino cubico a facce
centrate è osservabile nei composti ionici quali (LiF, NaCl, KCl,NaF tossico, MgO, CaO). Nelle figure che seguono viene illustrata la struttura del cloruro di sodio:
a) impaccato, b) e c) espanso per
osservare meglio la geometria del cristallo
Gli ioni
collegati da una linea sono a contatto. In tale tipo di
reticolo ciascun ione è circondato da altri sei ioni
di segno opposto (coordinazione 6:6). L'interazione di cui
bisogna tenere conto, pertanto, non è la semplice formazione
della coppia ionica Na+ Cl-, ma
qualcosa di più complesso che interessa forze attrattive e repulsive tra un più elevato numero di ioni. Il risultato è quello di una notevole stabilizzazione che facilita, dal punto di vista energetico,
la formazione del composto ionico: tale energia viene detta
energia reticolare.
 |
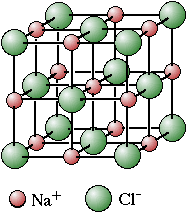 |
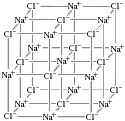
L'unità "formula" del composto ionico Cloruro di sodio è NaCl, con rapporto stechiometrico 1:1 tra gli ioni componenti il reticolo. |
(a) |
(b) |
(c) |
|
Reticolo cristallino del cloruro di sodio Modello interattivo NaCl: (JSmol) |
||
Il processo energetico della formazione di un composto ionico a partire dagli elementi fino alla formazione delle coppie ioniche spesso non risulta conveniente. Il ciclo energetico globale, cioè fino alla formazione del prodotto finale (cristallo), risulta favorevole perchè il computo energetico viene completato dall'energia reticolare.
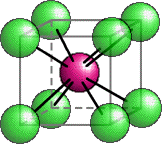
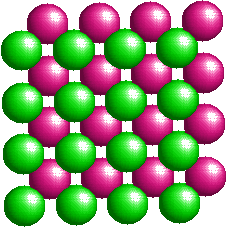
|
A sinistra è rappresentata la cella elementare del cloruro di cesio (Bromuro e Ioduro sono simili). Si tratta di un esempio di reticolo cristallino cubico a corpo centrato. Dalla cella elementare non appare chiaro il rapporto stechiometrico tra gli ioni componenti il reticolo. Nelle immagini seguenti ho rappresentato un numero maggiore di ioni. Le due figure, ruotate leggermente l'una rispetto all'altra, illustrano più chiaramente l'impacchettamento del reticolo cubico a corpo centrato e rendono conto del rapporto unitario tra il numero di ioni di carica opposta. |
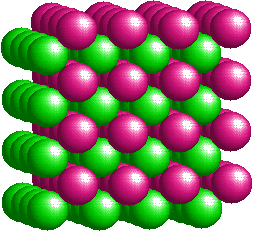
Modello interattivo CsCl: (JSmol)
Il diverso tipo di architettura e impaccamento osservabile nei casi su esposti, dipende in gran parte dalle dimensioni relative degli ioni costituenti il composto.
Modelli interattivi di NaCl e CsCl a confronto: (JSmol)
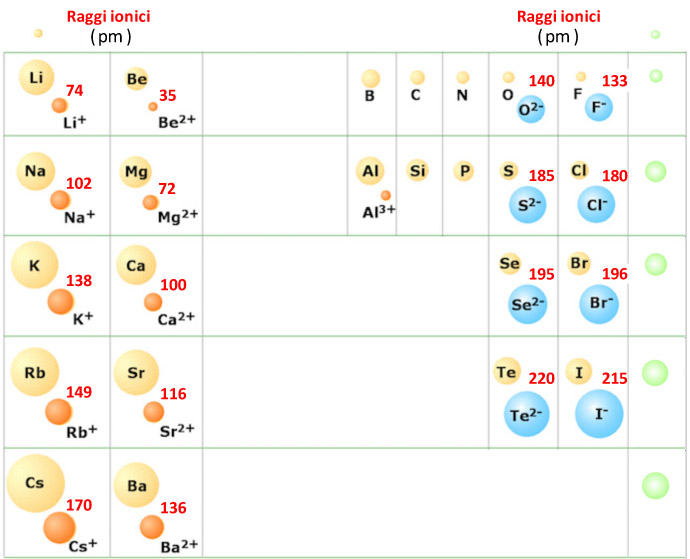
Nella figura seguente vengono illustrate le differenze tra le dimenioni atomiche e le dimensioni dei principali ioni di alcuni elementi. Gli ioni appaiono subito sotto gli elementiI spostati un poco a destra, in verde sono rappresentati i gas nobili.
APPROFONDIMENTO: L'energia reticolare e la costante di Madelung