Periodicità
Con l'aumentare del numero atomico, la configurazione elettonica degli atomi degli elementi mostra una variazione periodica (per interderci, al riempimento di un livello energetico fondamentale, i successivi elettroni ricominciano a riempire il livello energetico successivo). Questo si riflette anche sulle proprietà fisiche e chimiche. La legge sulla periodicità afferma che quando gli elementi sono ordinati secondo il numero atomico crescente, le loro proprietà variano periodicamente. Si tratta di un tentativo di addomesticare gli elementi, ma questo non sempre riesce bene; per intenderci la periodicità non è mai perfetta perchè ciascun elemento, pur avendo alcune caratterisiche simili a quelle di altri, nel globale ha caratteristiche uniche. Ad ogni modo, l'utilizzo delle caratterisiche simili risulta utilissimo in sede didattica. Qui di seguito ci riferiremo alle seguenti tre proprietà: Il raggio atomico, l'energia di ionizzazione e l'affinità per l'elettrone.
Raggio Atomico
Per raggio atomico apparente si intende la metà della distanza minima di avvicinamento tra due atomi della stessa specie in una molecola o in un cristallo. La dimensione della nuvola elettronica aumenta con l'aumentare del numero quantico principale n. Infatti scendendo lungo ogni gruppo essa tende ad aumentare di dimensione. Lungo un periodo gli atomi hanno lo stesso numero quantico principale, ma per ogni elemento successivo, la carica positiva del nucleo aumenta e ciò produce una maggiore attrazione della nuvola elettronica. La proprietà periodica consiste nel fatto che gli atomi tendono a diminuire di dimensione lungo un periodo; quando si ritorna al primo gruppo del successivo periodo, la dimensione dell'atomo ritorna improvvisamente ad aumentare perchè l'unico elettrone presente nel livello quantico successivo risulta schermato da quelli del livello quantico precedente.

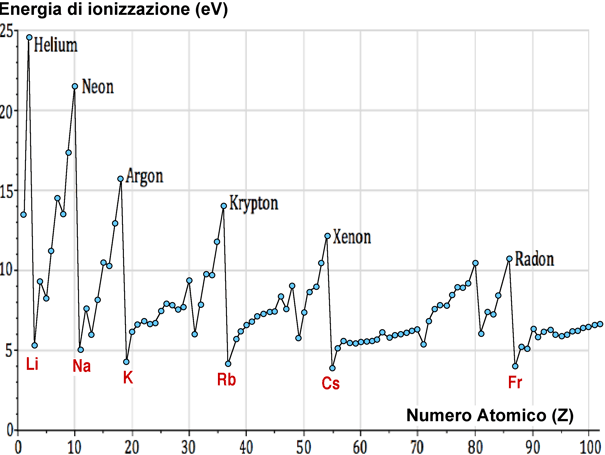
Energia di prima ionizzazione
Viene definita come l'energia necessaria per rimuovere l'elettrone più esterno di un atomo. L'energia di ionizzazione è una proprietà periodica. Infatti essa tende ad aumentare con l'aumentare del numero atomico orizzontalmente lungo un periodo, raggiungendo un massimo in corrispondenza dei gas nobili per poi ridiscendere improvvisamente all'inizio del successivo periodo. Subito dopo il riempimento degli orbitali s, l'elemento successivo che comincia a riempire gli orbitali p che sono ad un livello leggermente superiore, presenta un lieve abbassamento dell'energia di ionizzazione, in controtendenza al trend che è in aumento lungo lo stesso periodo. Scendendo lungo un gruppo, si osserva una graduale diminuzione dell'energia di ionizzazione perchè gli elettroni esterni appartengono ad un livello energetico maggiore, più vicino al livello di ionizzazione.
I metalli sono caratterizzati da un piccolo valore dell'energia di ionizzazione. All'aumentare del carattere non metallico aumenta il valore dell'energia di ionizzazione
Affinità per l'elettrone
La tendenza a guadagnare un elettrone da parte di un atomo di un certo elemento è chiamata affinità per l'elettrone. Quantitativamente essa è definita come l'energia messa in gioco quando un atomo cattura un elettrone.
Partiamo dal presupposto che un sistema è tanto più stabile quanto minore è la sua energia. Si consideri adesso un sistema costituito da un atomo isolato (gas) e un elettrone a debita distanza. Quando l'elettrone viene catturato dall'atomo, che diventa ione negativo, si possono verificare due casi
- Il sistema perde energia e la libera verso l'ambiente
circostante e quindi si stabilizza
X(g) + ne- X-(g) ΔE = negativo
X-(g) ΔE = negativo
esempio:
F(g) + e- F-(g) ΔE = -328 kJ mol-1
F-(g) ΔE = -328 kJ mol-1
- Il sistema guadagna energia a scapito dell'ambiente
circostante e quindi si destabilizza
X(g) + ne- X-(g) ΔE = positivo
X-(g) ΔE = positivo
Il criterio che abbiamo definito, dal punto di vista del sistema (atomo + elettroni), è detto egoistico. In questo caso valori più negativi hanno il significato di maggiore affinità per l'elettrone. Valori nulli o positivi indicano una scarsa tendenza ad acquistare un elettrone.
In termini di "tendenza" possiamo dire che gli elementi metallici hanno bassa affinità per l'elettrone mentre i non metalli manifestano maggiore affinità e presentano valori più negativi in termini di energia. L'affinità per l'elettrone è un dato difficile da determinare e pertanto è altrettando difficile fare delle generalizzazioni più precise.
Nella tabella seguente sono riportate, in termini di energia con il criterio egoistico, le affinità per l'elettrone (in kJ per mole) per la cattura di un elettrone di alcuni elementi rappresentativi:
| 1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 |
|
H
- 73 |
He > 0 |
||||||
|
Li - 60 |
Be > 0 |
B - 27 |
C - 122 |
N + 7 |
O - 141 |
F - 328 |
Ne > 0 |
|
Na - 53 |
Mg > 0 |
Al - 43 |
Si - 134 |
P - 72 |
S - 200 |
Cl - 350 |
Ar > 0 |
| K - 48 |
Ca - 2 |
Ge - 116 |
As - 78 |
Se - 195 |
Br - 325 |
Kr > 0 |
|
| Sr - 5 |
Sn - 116 |
Sb - 103 |
Te - 190 |
I - 295 |
Xe > 0 |
||
| Ba - 14 |
Pb - 35 |
Ecco adesso dei valori di affinità per l'elettrone (espresse sempre in kJ per mole) che riguardano la cattura di due elettroni (si nota una destabilizzazione del sistema durante l'acquisto di un secondo elettrone):
|
O + 840 |
S + 530 |
Se + 650 |