Tabella riassuntiva dei numeri quantici e degli orbitali
- Numero quantico principale (n) - Caratterizza la dimensione (distanza media dal nucleo) e l'energia che compete agli elettroni. Può assumere valori interi a partire da 1.
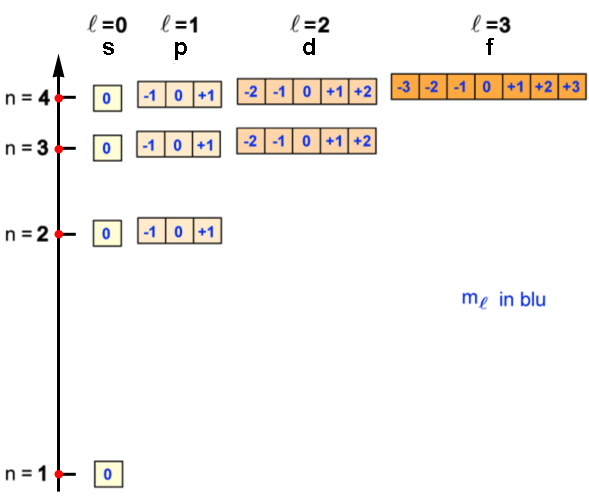
- Numero quantico angolare o azimutale (
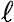 ) - Descrive la forma degli orbitali. Può assumere valori interi da zero ad (n-1) ed al numero viene associata una lettera derivata dalle particolari caratteristiche spettrali (s, p, d, f). Nel lucido successivo vedremo alcune forme degli orbitali.
) - Descrive la forma degli orbitali. Può assumere valori interi da zero ad (n-1) ed al numero viene associata una lettera derivata dalle particolari caratteristiche spettrali (s, p, d, f). Nel lucido successivo vedremo alcune forme degli orbitali. - Numero quantico magnetico ml - Indica come è orientato l'orbitale nello spazio. Può assumere valori interi da -
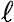 a +
a +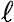 , compreso lo zero.
, compreso lo zero. - Numero quantico magnetico di spin ms - Definisce la rotazione dell'elettrone attorno al proprio asse. Assume due soli valori +1/2 e -1/2 (spin opposto).
| Livello n |
SottoLivello |
Notazione SottoLivello |
Orientazione m |
Spin ms |
Numero di Orbitali |
|
| 1 | 0 | 1s | 0 | +1/2, -1/2 | 1 | 1 |
| 2 | 0 | 2s | 0 | +1/2, -1/2 | 1 | 4 |
| 1 | 2p | -1 0 +1 | +1/2, -1/2 | 3 | ||
| 3 | 0 | 3s | 0 | +1/2, -1/2 | 1 | 9 |
| 1 | 3p | -1 0 +1 | +1/2, -1/2 | 3 | ||
| 2 | 3d | -2 -1 0 +1 +2 | +1/2, -1/2 | 5 | ||
| 4 | 0 | 4s | 0 | +1/2, -1/2 | 1 | 16 |
| 1 | 4p | -1 0 +1 | +1/2, -1/2 | 3 | ||
| 2 | 4d | -2 -1 0 +1 +2 | +1/2, -1/2 | 5 | ||
| 3 | 4f | -3 -2 -1 0 +1 +2 +3 | +1/2, -1/2 | 7 | ||
| NOTE: |
|
La figura seguente rappresenta un altro modo per visualizzare i numeri quantici e gli orbitali atomici corrispondenti (energie crescenti dal basso verso l'alto):
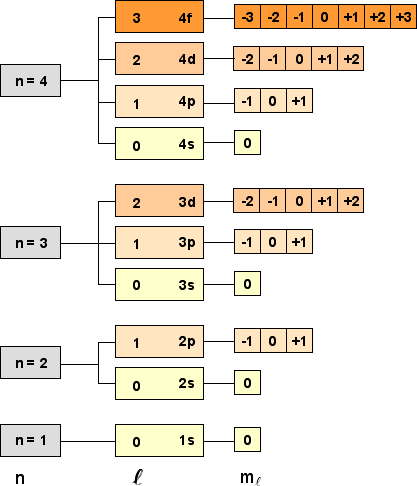 |
|
Infine, qui di seguito, un altro modo ancora per visualizzare i numeri quantici e gli orbitali corrispondenti (NOTA: il dislivello energetico non è in perfetta scala):