Leggi fondamentali della CHIMICA
(Breve cronistoria)
- Legge della conservazione delle masse (A.L. Lavoisier)
- Legge della composizione definita (Proust)
- Legge delle proporzioni multiple (Dalton)
Legge della conservazione delle masse (A.L. Lavoisier)
La somma delle masse delle sostanze reagenti
è uguale alla somma delle masse dei prodotti (a
reazione ultimata), ovvero, in una reazione chimica la materia non si crea e non si distrugge.
Legge della composizione definita (Proust)
Diversamente da quello che succede per una miscela, un certo composto chimico, indipendentemente dalla sua origine, è sempre
formato dagli stessi elementi e, se questi si combinano fra di
loro per formare quel composto, lo fanno sempre nelle stesse
proporzioni (1:8 per l'esempio seguente)
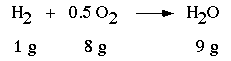
Legge delle proporzioni multiple (Dalton)
Quando più elementi si possono combinare
tra di loro per formare più di un composto, lo fanno
mantenendo rapporti interi e piccoli. es:
SO2, SO3
Dalton (1804-8) inaugura la teoria atomica: Quando due elementi possono formare più composti differenti, lo fanno combinandosi in rapporti semplici ed interi.
| a) | la materia è composta da particelle indivisibili e indistruttibili (atomi) | |
| b) | tutti gli atomi di un elemento sono uguali | |
| c) | atomi di differenti elementi hanno differente massa e differenti proprietà chimiche | |
| d) | un composto è un tipo di materia costituita da atomi di due o più elementi diversi uniti in proporzioni fisse espresse da sempici numeri interi | |
| e) | gli atomi si mantengono inalterati durante le reazioni chimiche per cui si combinano in rapporti semplici ed interi

|