I gas si sciolgono nei solventi liquidi e la loro solubilità dipende da una serie di fattori. La classica espressione "il simile scioglie il simile" va adattata in "un liquido scioglie meglio il gas con cui può interagire più fortemente". Altri fattori che modificano la quantità di gas che si "scioglie" nel solvente liquido sono la Temperatura e la Pressione esercitata del gas sulla fase liquida.
Se vogliamo paragonare la solubilità di gas diversi in un determinato solvente dobbiamo riferirci ad una ben precisa pressione parziale dei gas (solitamente 1 atm) e specificare la temperatura.
Il fenomeno complessivo di soluzione per un gas è sempre esotermico a causa delle maggiori interazioni molecolari quando le particelle di gas sono all'interno a contatto con quelle del liquido.
| soluto(gas)
+ Solvente |
ΔH < 0 |
Per il principio di Le Chatelier, il processo viene spinto verso sinistra da un aumento della temperatura, pertanto la solubilità dei gas diminuisce all’aumentare della temperatura (problemi per i pesci se la temperatura dell'acqua di mare aumenta perchè ciò comporta la riduzione di ossigeno disciolto)
Variazione della solubilità di alcuni gas, alla pressione costante di 1 atm, in funzione della temperatura |
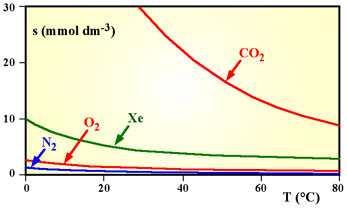 |
Nella seguente tabella sono correlate le solubilità di alcuni gas, in acqua, con la loro temperatura di ebollizione: i valori sono riferiti a 273K e 1 atm di pressione parziale.
 |
Polarizzabilità |
I gas sono ordinati secondo la temperatura di ebollizione crescente (la temperatura di ebollizione cresce al crescere della polarizzabilità). Si nota un aumento della solubilità nella stessa direzione. Ciò è spiegabile perchè l'acqua è un solvente polare e pertanto scioglierà meglio le molecole più polarizzabili.
A temperatura costante, la quantità di gas che si scioglie in un solvente liquido dipende dalla pressione parziale che il gas esercita sul liquido stesso. Il chimico inglese William Henry (12.12.1775 ÷ 2.9.1836) definì una legge, valida per parecchi gas e per pressioni non troppo elevate, che correlava la solubilità del gas alla pressione esercitata dal gas stesso. Il modo più semplice per esprimerla è quella di considerare la solubilità del gas direttamente proporzionale alla pressione parziale esercitata dal gas sulla superficie del liquido. La costante di proporzionalità è la costante di Henry:
| s(gas) = k(gas/solv.) . P(gas.) |
Il significato qualitativo dell'espressione è immediato: aumentando la pressione esercitata dal gas sul liquido, dopo un certo tempo di riequilibrio, aumentano pure il numero di particelle gassose che superano la barriera superficiale verso l'interno del liquido producendo un aumento della concentrazione del gas disciolto.
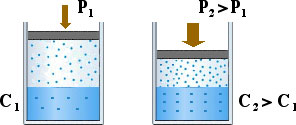
Se si utilizza l’espressione precedente, la costante di Henry, ad una certa temperatura, indicata pure come kH, rappresenta la solubilità del gas quando la sua pressione parziale assume il valore unitario. Una delle sue possibili unità di misura può essere mol/(L atm) ovvero mol L-1 atm-1. Ovviamente il suo valore, oltre che dall'unità di misura adottato, dipende dalla temperatura e dalla specifica coppia soluto(gas)/solvente(liq.) .
Uno dei libri adottati (Fondamenti di chimica, Schiavello) utilizza una forma diversa per formulare la legge di Henry. Infatti, oltre ad esprimere la concentrazione del gas in frazione molare invece della molarità, utilizza una costante di tipo inverso:
Utilizzando questa formulazione, le dimensioni della costante risultano quelle di una pressione. |
La legge di Henry non viene seguita da tutti i gas. In alcuni casi le deviazioni dalla linearità sono minime ma in altri casi assai vistosi. Ecco quali requisiti deve avere il gas per rispettare, entro certi limiti, la legge di Henry:
a) Deve essere poco solubile. A tal proposito mentre CO2 rientra quasi nei limiti, non vanno bene gas come H2S e Cl2 che risultano piuttosto solubili.
b) Lo stato molecolare del gas deve mantenersi anche in soluzione. In pratica non si devono verificare reazioni che consumano in qualche modo il gas sottraendolo all'equilibrio di solubilità:
1) forti interazioni acido base:
HCl + H2O ![]() Cl- + H3O+
Cl- + H3O+
SO2 + 2 H2O ![]() HSO3- + H3O+ Ka = 1.5 × 10-2
HSO3- + H3O+ Ka = 1.5 × 10-2
2) forti interazioni con il solvente (es. Ammoniaca in acqua per forti legami idrogeno)
3) reazioni causate dal solvente (es. disproporzioni)
Tutti i casi in b) conducono ad una accresciuta solubilità. Apparente in 1) e 3), effettiva nei casi 2).
Una nota merita il caso dell'ammoniaca in acqua. Ho letto in alcuni testi che la causa della sua grande solubilità e che viene sottratta all'equilibrio gassoso dal suo comportamento basico:
NH3 + H2O ![]() NH4+ + OH- Kb = 1.8 × 10-5
NH4+ + OH- Kb = 1.8 × 10-5
Il valore molto piccolo della costante di equilibrio determina certamente il pH della soluzione ma non consuma una grande massa di ammoniaca. Come già accennato, la causa della sua grande solubilità è dovuta alle forti interazioni di legame idrogeno con l'acqua.
 |
Uno dei libri consigliati (Chimica - Kotz, Treichel) mostra una tabella, molto misera di dati a dire il vero, nella quale non specifica il solvente cui fanno riferimento le costanti di Henry indicate. Il solvente è l'acqua. Il sito indicato nella tabella stessa non è più raggiungibile. Se si desidera un maggior numero di dati di costanti di Henry, sempre riferite al solvente acqua, visitate il sito Wikipedia in inglese (http://en.wikipedia.org/wiki/Henry'_law). Sconsiglio vivamente il corrispondente sito in lingua italiana. |