Calcolo del pH delle soluzioni acquose (3a parte)
Reazione di un acido debole con una base forte (in soluzione)
Si supponga di far reagire acido acetico
e idrossido di sodio e che siano note le quantità, espresse
in moli o millimoli, delle sostanze reagenti. Sono possibili tre casi
(le quantità utilizzate sono puramente indicative):
a) eccesso di acido (10 millimoli di acido + 4 millimoli
di base)
b) quantità equivalenti (10 millimoli di acido
+ 10 millimoli di base)
c) eccesso di base (10 millimoli di acido + 11 millimoli
di base)
caso a: il pH si calcola considerando
il tampone "acido acetico/acetato". La soluzione tampone sarà
presente sino a quando verranno utilizzate quantità di base inferiori
all'acido
| |
CH3COOH |
+ |
NaOH |
 |
CH3COONa |
+ |
H2O |
| iniziali |
10 |
|
4 |
|
|
|
|
| reagiscono |
4 |
|
4 |
|
|
|
|
| si formano |
|
|
|
|
4 |
|
4 |
| fine reazione |
6 |
|
- |
|
4 |
|
4 |
caso b: il pH si calcola considerando
l'idrolisi del sale (base coniugata dell'acido debole)
| |
CH3COOH |
+ |
NaOH |
 |
CH3COONa |
+ |
H2O |
| iniziali |
10 |
|
10 |
|
|
|
|
| reagiscono |
10 |
|
10 |
|
|
|
|
| si formano |
|
|
|
|
10 |
|
10 |
| fine reazione |
- |
|
- |
|
10 |
|
10 |
caso c: il pH è dovuto
all'eccesso di base forte e va calcolato dalla concentrazione molare
di tale eccesso
| |
CH3COOH |
+ |
NaOH |
 |
CH3COONa |
+ |
H2O |
| iniziali |
10 |
|
11 |
|
|
|
|
| reagiscono |
10 |
|
10 |
|
|
|
|
| si formano |
|
|
|
|
10 |
|
10 |
| fine reazione |
- |
|
1 |
|
10 |
|
10 |
Reazione di una base debole con un acido forte (in soluzione)
Si supponga di far reagire ammoniaca
con acido cloridrico (provare anche acido nitrico e acido perclorico)
e che siano note le quantità, espresse in moli o millimoli, delle
sostanze reagenti. Sono possibili tre casi (le quantità utilizzate
sono puramente indicative):
a) eccesso di base (10 millimoli di base + 4 millimoli
di acido)
b) quantità equivalenti (10 millimoli di base
+ 10 millimoli di acido)
c) eccesso di acido (10 millimoli di base + 11 millimoli
di acido)
caso a: il pH si calcola considerando
il tampone "ammoniaca/ammonio". La soluzione tampone sarà
presente sino a quando verranno utilizzate quantità di acido
inferiori alla base
| |
NH3 |
+ |
HCl |
 |
NH4Cl |
| iniziali |
10 |
|
4 |
|
|
| reagiscono |
4 |
|
4 |
|
|
| si formano |
|
|
|
|
4 |
| fine reazione |
6 |
|
- |
|
4 |
caso b: il pH si calcola considerando
l'idrolisi del sale (acido coniugato della base debole NH3)
| |
NH3 |
+ |
HCl |
 |
NH4Cl |
| iniziali |
10 |
|
10 |
|
|
| reagiscono |
10 |
|
10 |
|
|
| si formano |
|
|
|
|
10 |
| fine reazione |
- |
|
- |
|
10 |
caso c: il
pH è dovuto all'eccesso di acido forte e va calcolato dalla concentrazione
molare di tale eccesso
| |
NH3 |
+ |
HCl |
 |
NH4Cl |
| iniziali |
10 |
|
11 |
|
|
| reagiscono |
10 |
|
10 |
|
|
| si formano |
|
|
|
|
10 |
| fine reazione |
- |
|
1 |
|
10 |
Reazione tra un sale (base di Brønsted) e un acido forte
Erano dette anche reazioni di spostamento di
un acido dal suo sale. Si supponga di far reagire acetato di sodio
con acido cloridrico le cui quantità, espresse in moli
o millimoli, siano note. Sono possibili tre casi (le quantità
utilizzate sono puramente indicative):
a) eccesso di sale (10 millimoli di sale + 4 millimoli
di acido)
b) quantità equivalenti (10 millimoli di sale
+ 10 millimoli di acido)
c) eccesso di acido (10 millimoli di sale + 11 millimoli
di acido)
caso a: il pH si calcola considerando
il tampone "acido acetico/acetato". La soluzione tampone sarà
presente sino a quando verranno utilizzate quantità di acido
inferiori al sale
| |
CH3COONa |
+ |
HCl |
 |
CH3COOH |
+ |
NaCl |
| iniziali |
10 |
|
4 |
|
|
|
|
| reagiscono |
4 |
|
4 |
|
|
|
|
| si formano |
|
|
|
|
4 |
|
4 |
| fine reazione |
6 |
|
- |
|
4 |
|
4 |
caso b: il pH è dovuto
all'acido debole ottenuto come prodotto e va calcolato dalla sua concentrazione molare
utilizzando la relativa formulazione
| |
CH3COONa |
+ |
HCl |
 |
CH3COOH |
+ |
NaCl |
| iniziali |
10 |
|
10 |
|
|
|
|
| reagiscono |
10 |
|
10 |
|
|
|
|
| si formano |
|
|
|
|
10 |
|
10 |
| fine reazione |
- |
|
- |
|
10 |
|
10 |
caso c: il
pH è dovuto all'eccesso di acido forte e va calcolato dalla concentrazione
molare di tale eccesso
| |
CH3COONa |
+ |
HCl |
 |
CH3COOH |
+ |
NaCl |
| iniziali |
10 |
|
11 |
|
|
|
|
| reagiscono |
10 |
|
10 |
|
|
|
|
| si formano |
|
|
|
|
10 |
|
10 |
| fine reazione |
- |
|
1 |
|
10 |
|
10 |
Reazione tra un sale (acido di Brønsted) e una base forte
Erano dette anche reazioni di spostamento di
una base dal suo sale. Si supponga di far reagire cloruro di ammonio
con idrossido di sodio le cui quantità, espresse
in moli o millimoli, siano note. Sono possibili tre casi (le quantità
utilizzate sono puramente indicative):
a) eccesso di sale (10 millimoli di sale + 4 millimoli
di base)
b) quantità equivalenti (10 millimoli di sale
+ 10 millimoli di base)
c) eccesso di base forte (10 millimoli di sale +
11 millimoli di base)
caso a: il pH si calcola considerando
il tampone "ammoniaca/ammonio". La soluzione tampone sarà
presente sino a quando verranno utilizzate quantità di base inferiori
al sale
| |
NH4Cl |
+ |
NaOH |
 |
NH3 |
+ |
NaCl |
+ |
H2O |
| iniziali |
10 |
|
4 |
|
|
|
|
|
|
| reagiscono |
4 |
|
4 |
|
|
|
|
|
|
| si formano |
|
|
|
|
4 |
|
4 |
|
4 |
| fine reazione |
6 |
|
- |
|
4 |
|
|
|
4 |
caso b: il pH è dovuto
alla base debole ottenuta come prodotto e va calcolato dalla sua concentrazione molare
utilizzando la relativa formulazione
| |
NH4Cl |
+ |
NaOH |
 |
NH3 |
+ |
NaCl |
+ |
H2O |
| iniziali |
10 |
|
10 |
|
|
|
|
|
|
| reagiscono |
10 |
|
10 |
|
|
|
|
|
|
| si formano |
|
|
|
|
10 |
|
10 |
|
10 |
| fine reazione |
- |
|
- |
|
10 |
|
10 |
|
10 |
caso c: il pH è dovuto
all'eccesso di base forte e va calcolato dalla concentrazione molare
di tale eccesso
| |
NH4Cl |
+ |
NaOH |
 |
NH3 |
+ |
NaCl |
+ |
H2O |
| iniziali |
10 |
|
11 |
|
|
|
|
|
|
| reagiscono |
10 |
|
10 |
|
|
|
|
|
|
| si formano |
|
|
|
|
10 |
|
10 |
|
10 |
| fine reazione |
- |
|
1 |
|
10 |
|
10 |
|
10 |
TITOLAZIONE di un acido DEBOLE con una base FORTE
Le reazioni illustrate in questa pagina spiegano l'andamento
del pH nelle titolazioni del tipo acido debole-base forte e base debole-acido forte.
Discuteremo sola la prima categoria.
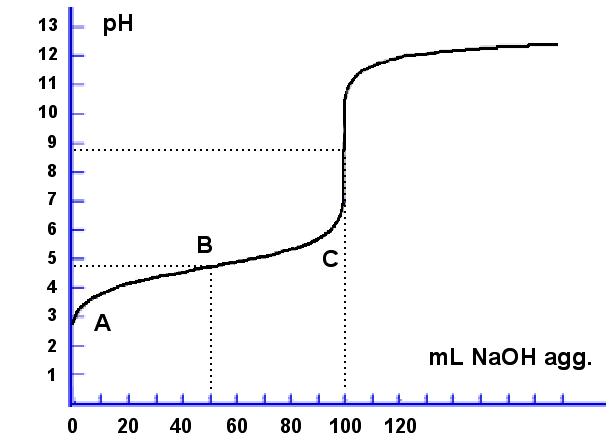 Supponiamo
di porre in un beker, munito di sistema di agitazione magnetica, 100 mL di acido
acetico 0.1 M e di utilizzare come titolante la base forte NaOH alla concentrazione
0.1 M. Il pH iniziale, prima di qualunque aggiunta di titolante, se provate a rifare
i calcoli, risulta poco meno di 3. Aggiungendo NaOH, si determina
la formazione di acetato di sodio (base coniugata di CH3COOH). In una
prima fase, essendo eccessivo il rapporto tra acido debole e sua base coniugata,
il tampone risultante non risulta affatto efficiente ed il pH varia in maniera non
lineare (zona A). Supponiamo
di porre in un beker, munito di sistema di agitazione magnetica, 100 mL di acido
acetico 0.1 M e di utilizzare come titolante la base forte NaOH alla concentrazione
0.1 M. Il pH iniziale, prima di qualunque aggiunta di titolante, se provate a rifare
i calcoli, risulta poco meno di 3. Aggiungendo NaOH, si determina
la formazione di acetato di sodio (base coniugata di CH3COOH). In una
prima fase, essendo eccessivo il rapporto tra acido debole e sua base coniugata,
il tampone risultante non risulta affatto efficiente ed il pH varia in maniera non
lineare (zona A).
Quando la concentrazione di CH3COO- raggiunge
valori compatibili con un funzionamento adeguato del sistema tampone, il pH varierà gradualmente
con costanza (zona tampone B).
Quando la quantità di base forte aggiunta è la metà dell'acido debole, il pH misurato dovrà essere uguale alla pKa dell'acido debole (pH = pKa = -log(1.8x10-5)=4.75,
Quando la quantità di base forte aggiunta si approssima al punto di equivalenza e l'acido debole si sta quasi consumando, il rapporto [acido debole] / [base coniugata] diventa troppo piccolo e il sistema tampone comincia a cedere (zona C: precede il P.E.). Al raggiungimente del punto di equivalenza si ha la consueta variazione repentina del pH. Il pH al punto di equivalenza risulta all'incirca 8.7 ed è dovuto alla base coniugata.
Se siamo interessati semplicemente alla determinazione del P.E. possiamo effettuare la titolazione utilizzando un indicatore di pH con un pK nell'intorno del pH del punto di equivalenza. Nel case di titolazione come quella descritta la fenolftaleina (pKind = 9.3) è una sostanza che va benissimo. Qui di seguito riporto una banale mini-simulazione, in cui si evidenzia la repentina variazione di colore dell'indicatore fenolftaleina che passa da "incolore" a "rosso".
Start
Stop
Reset
|
COME SI USA la mini simulazione:
a) Per effettuare singole aggiunte fare un click
nella zona del rubinetto della buretta
b) Con click su Start per farla procedere
in automatico. (Stop si ferma, Reset ricomincia
da zero con una nuova simulazione, Start riprende se era stata stoppata). |
|
 Supponiamo
di porre in un beker, munito di sistema di agitazione magnetica, 100 mL di acido
acetico 0.1 M e di utilizzare come titolante la base forte NaOH alla concentrazione
0.1 M. Il pH iniziale, prima di qualunque aggiunta di titolante, se provate a rifare
i calcoli, risulta poco meno di 3. Aggiungendo NaOH, si determina
la formazione di acetato di sodio (base coniugata di CH3COOH). In una
prima fase, essendo eccessivo il rapporto tra acido debole e sua base coniugata,
il tampone risultante non risulta affatto efficiente ed il pH varia in maniera non
lineare (zona A).
Supponiamo
di porre in un beker, munito di sistema di agitazione magnetica, 100 mL di acido
acetico 0.1 M e di utilizzare come titolante la base forte NaOH alla concentrazione
0.1 M. Il pH iniziale, prima di qualunque aggiunta di titolante, se provate a rifare
i calcoli, risulta poco meno di 3. Aggiungendo NaOH, si determina
la formazione di acetato di sodio (base coniugata di CH3COOH). In una
prima fase, essendo eccessivo il rapporto tra acido debole e sua base coniugata,
il tampone risultante non risulta affatto efficiente ed il pH varia in maniera non
lineare (zona A). 
