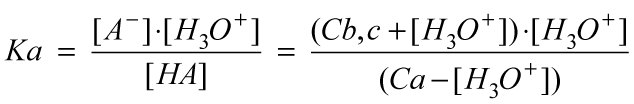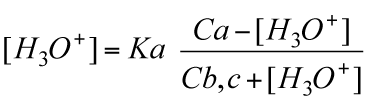Deduzione analitica della formula tampone.
Come giá detto, un tampone puó essere ottenuto mescolando un acido debole (HA) e un sale con lo scopo di introdurre la sua base coniugata (es. un sale di un elemento alcalino: NaA):
HA(aq) + H2O(l) 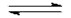 A-(aq) + H3O+(aq) A-(aq) + H3O+(aq)
NaA(s) + H2O(l)  A-(aq) + Na+(aq) A-(aq) + Na+(aq)
La tabella che segue servirá per la deduzione analitica della formula del tampone. Tutti i punti evidenziati verranno spiegati subito dopo. Nella tabella utilizzo le concentrazioni in quanto mi riferisco sempre ad un litro di soluzione per cui le concentrazioni coincidono con le moli. Nella maggior parte dei casi é possibile trascurare l'equilibrio ionico dell'acqua perché é alquanto improbabile che una soluzione tampone sia utilizzata ad una concentrazione inferiore a 0.002 molare.
| 0 |
|
HA(aq |
+ H2O(l) |
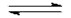 |
A-(aq) |
+ |
H3O+(aq) |
| 1 |
iniziali |
Ca |
|
|
- |
|
- |
| 2 |
reagiscono |
x |
|
|
- |
|
- |
| 3 |
si formano |
- |
|
|
x |
|
x |
| 4 |
equilibrio 1 |
(Ca - x) |
|
|
(x) |
|
(x) |
| |
|
|
|
|
|
|
|
| 5 |
Add |
- |
|
|
Cb,c |
|
- |
| 6 |
reagiscono |
- |
|
|
y |
|
y |
| 7 |
si formano |
y |
|
|
- |
|
- |
| 8 |
equilibrio 2 |
Ca-x+y |
|
|
x + Cb,c - y |
|
(x-y) |
| 9 |
(x-y)=[H3O+ |
Ca - [H3O+] |
|
|
Cb,c + [H3O+] |
|
[H3O+] |
| 0) |
Schema della reazione dell'acido debole con l'acqua e la formazione degli ioni acquosi idrossonio H3O+. e la base coniugata A- . |
| 1) |
Concentrazione iniziale dell'acido debole (conc. analitica) |
| 2) |
Indichiamo con x la parte dell'acido che reagisce (o si dissocia). |
| 3) |
Formazione degli ioni prodotto, pari alla quantità dissociata dell'acido. |
| 4) |
Condizione all'equilibrio (sfondo giallo). |
| 5) |
Si aggiunge il sale (ovvero la base coniugata) in concentrazione Cb,c |
| 6) |
L'equilibrio viene spostato verso sinistra (reagiscono quantità y delle due tipologie di ioni secondo il principio di Le Chatelier nel rispetto della stechiometria. |
| 7) |
Con l'equilibrio che si sposta verso sinistra, si formano y moli/L dell'acido HA. |
| 8) |
Nuova condizione di equilibrio 2 che tiene conto delle variazioni rispetto all'equilibrio 1. |
| 9) |
Tenendo condo che (x-y) risulta la conc. degli lioni idrossonio, si sostituisce tale valore nelle concentrazioni di HA e A- con il risultato proposto sullo sfondo verde. |
Scriviamo la costante di equilibirio della reazione (Ka) nei termini del quoziente e sostituiamo i valori ottenuti alla fine nello sfondo verde:
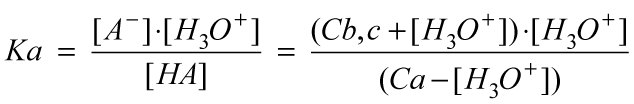
Ricaviamo [H3O+] :
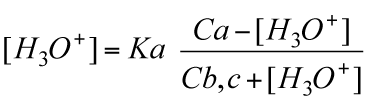
che risulta, naturalmente, uguale a quella dedotta qualitativamente.
|