Ancora sugli stati di aggregazione della materia e relazione qualitativa con
i modelli del legame chimico
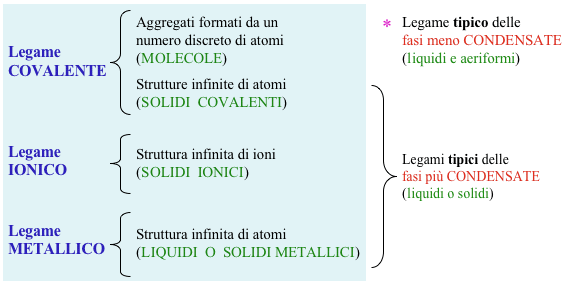
Generalità
Lo stato fisico delle sostanze, a
parità di temperatura
e pressione, dipende dal tipo di legame esistente tra le molecole o ioni che le costituiscono.
La tipologia di legame che si stabilisce tra le molecole determina l'energia necessaria
per modificare lo stato di aggregazione.
A livello atomico o molecolare lo stato
di aggregazione rende conto della distanza tra le particelle e della loro libertà
di movimento.
Come senso comune (non perfettamente scientifico) definiamo solide, liquide
o aeriformi, le sostanze che sono in quella specifica condizione a temperatura e
pressione prossime a quelle definite come ambientali. Modificando le condizioni
di temperatura e pressione, tutte le sostanze, se non subiscono trasformazioni chimiche
o decomposizione, possono essere solide, liquide o aeriformi. Aumentando la temperatura
si verifica un aumento dell'energia cinetica posseduta dalle molecole con maggiore
possibilità
di rottura dei legami coesivi (energia potenziale). Superati certi limiti di temperatura
si verificano transizioni di fase verso stati di aggregazione meno condensati. Per
contro tutte le sostanze si possono trovare allo stato solido, basta abbassare la
temperatura al di sotto di un certo valore.
Lo stato SOLIDO
Nello stato solido, le forze attrattive esistenti tra
le particelle, che possono essere di intensità molto diversa, prevalgono ampiamente sull'effetto dell'agitazione termica. Ciò comporta
una ridotta libertà di movimento limitata a moti vibrazionali.
Le
sostanze allo stato solido sono pressoché incomprimibili
e rigide, pertanto hanno forma e dimensione propria. Esistono sostanzialmente
due classi di solidi:
Cristallini e Amorfi.
Nei solidi cristallini
si hanno strutture
perfettamente definite a livello ionico
o molecolare secondo uno schema geometrico caratteristico, mentre nei
solidi amorfi
(senza
forma) si osservano disposizioni piuttosto casuali.
Solidi ionici: (attrazione ione-ione)
Per questi tipi di solidi le
posizioni reticolari sono occupate da ioni. Presentano punti di fusione relativamente
alti. Sono piuttosto duri ma altrettanto fragili. Hanno bassa conducibilità elettrica
allo stato solido (conducono allo stato liquido). Normalmente sono solubili in solventi polari.
| Sostanza |
si presenta come |
P.F. (°C) |
| LiNO3 |
solido cristallino bianco |
255 |
| K2Cr2O7 |
solido cristallino arancione |
398 |
| LiCl |
solido cristallino bianco |
613 |
| NaCl |
solido cristallino bianco |
801 |
| NH4Cl |
solido cristallino bianco |
338 |
| NaNO3 |
solido cristallino bianco |
339 |
Solidi molecolari: (interazioni deboli)
Per questi tipi di solidi le
posizioni reticolari sono occupate da molecole tenute insieme da forze di van der Waals e legami idrogeno. Fondono o sublimano a temperature
relativamente basse dipendenti dalle interazioni molecolari (es. il glucosio
presenta forti interazioni e il saccarosio, di dimensioni maggiori, presenta interazioni
ancora più forti). Sono di consistenza tenera e conducono molto male sia la corrente elettrica che il calore.
| Sostanza |
si presenta come |
P.M |
P.F. (°C) |
| Ossigeno (O2) * |
solido azzurro (32 u.m.a.) |
32 |
-219 |
| Cloro (Cl2) * |
solido giallo-verde |
71 |
-101 |
| Fosforo bianco (P4) * |
pasta biamco-giallognola |
124 |
44.1 |
| Iodio (I2) * |
solido nero violaceo lucente |
253 |
113.6 |
| Zolfo (S8) * |
cristalli gialli (rombico o monoclino) |
256 |
115.2 |
| Naftalene |
solido cristallino bianco |
|
79 |
| Ac.Acetico CH3COOH |
Solido bianco |
|
17 |
| Glucosio (C6H12O6)
JSmol view
|
solido cristallino bianco |
|
146 |
| Saccarosio (C12H22O11)
JSmol view
|
solido cristallino bianco |
|
185 |
| CO2 |
solido bianco (sublima) |
|
-78 |
| H2O |
solido bianco |
|
0.0 |
| * Sostanze elementari (molecole apolari) in ordine di peso molecolare crescente. |
Solidi covalenti: (legame covalente)
Le posizioni reticolari di questi tipi di solidi sono occupate da atomi legati tra
loro mediante legami covalenti, il tutto produce una molecola gigante estesa a tutto
il cristallo. Sono moldo duri, presentano temperature di fusione molto elevate e sono cattivi conduttori del calore e dell'elettricità. Tra i composti più noti che sono solidi covalenti citiamo il diamante
(JSmol view)
, una forma allotropica del carbonio in cui tutti gli atomi hanno ibridazione sp3 con struttura tetraedrica, e il quarzo_alfa
(JSmol view)
, una forma cristallina del diossido di silicio.
| Sostanza |
si presenta come |
P.F. (°C) |
| C (diamante) |
solido cristallino trasparente |
1610 |
| SiO2 (quarzo) |
solido cristallino trasparente |
Circa 4000 |
Solidi metallici : (legame metallico)
Le posizioni reticolari di questi tipi di solidi sono occupate da ioni dei metalli (cationi): gli elettroni di valenza, in maniera complessa, tengono salda la struttura pur essedo altamente delocalizzati. La delocalizzazione degli elettroni rende conto delle proprietà di questi solidi: elevata conduttività termica ed elettrica, duttilità, malleabilità e lucentezza. Hanno temperature di fusione molto variabili (per esempio: Na = 99°C; Sn = 232°C; Pb = 327°C; Au = 1064°C; Fe = 1535°C) e si passa da metalli molto teneri (metalli alcalini) ad altri molto duri (es. titanio)
Lo stato LIQUIDO
I liquidi non hanno forma propria, ma assumono quella del recipiente che li contiene.
Lo stato liquido è uno stato condensato e le particelle sono legate l’una
all’altra con forze
sufficienti a mantenere la complessiva aggregazione.
All’interno del liquido non è presente la struttura ordinata tipica dei solidi. Le molecole possono scorrere le une sulle altre e godono di una certa libertà di movimento anche se decisamente inferiore a quella posseduta dalle molecole di una gas nei quali risultano quasi del tutto indipendenti le une dalle altre. Questo fa sì che i liquidi non abbiano una forma decisamente propria, ma assumono, trascurando i fenomeni interfacciali, quella del recipiente in cui si adagiano.
I liquidi hanno volume proprio e sono pressoché incomprimibili.
In funzione del tipo di sostanza liquida che andiamo a considerare, le molecole possono
incontrare maggiore o minore resistenza a muoversi all’interno del liquido
stesso; maggiore è la
resistenza che incontrano, maggiore è la viscosità del liquido. La
viscosità di
un liquido in genere diminuisce all'aumentare della temperatura e viceversa.
Liquidi ionici:
nei quali le particelle sono ioni (sali fusi o particolarissime sostanze organiche)
liquidi
molecolari:
costituiti da molecole
discrete (acqua pf. 0°C, benzene pf. 5.5°C, cicloesano pf. 6°C)
liquidi metallici:
metalli liquidi o fusi, costituiti come i metalli solidi ma gli ioni sono mobili.
Lo stato fisico di quasi tutti i metalli, a 25°C,
è quello solido. Fa eccezione il mercurio (Hg) che fonde a circa -39°C.
Ci sono metalli che fondono poco sopra 25° (francio 27, cesio 28.5,
gallio 29.8), mentre altri fondono a temperature che superano i 3000 gradi centigradi (tungsteno 3410, renio 3180,
osmio 3045)
Nel link
seguente presento una tabella periodica che mostra, sfruttando l'intensità di
colore variabile, la temperatura di fusione degli elementi. Al passaggio del mouse
viene visualizzato il valore effettivo (Tabella dei punti di
fusione).
Relazione qualitativa tra i modelli del legame chimico e stato fisico
* Molte sostanze costituite da molecole discrete,
a temperature ordinarie, possono presentarsi allo stato solido o liquido a causa
delle relativamente forti "forze di coesione intermolecolari" (es
Br2, I2, H2O, C6C6, C6H12O6,
C12H22O11 etc.)
|