 |
Tabella periodica degli elementi (Tabella ordinata degli elementi) |
 |
Intorno al 1860-1870 il numero di elementi scoperti era diventato abbastanza numeroso (circa 63) da convincere i chimici circa la necessità di organizzarli in maniera ordinata e sistematica in base alle loro proprietà. Dopo numerosi tentativi la prima migliore soluzione venne nel 1871 quando Dmitri Ivanovitch Mendelèev (chimico Russo 1834-1907) pubblicò la versione definifiva della sua tavola periodica. Egli raggruppò gli elementi basandosi sia sulla loro massa atomica che sulle loro proprietà chimiche, lasciando spazi bianchi per quelli non ancora conosciuti, prevedendone alcune proprietà. Attualmente le tavole periodiche sono organizzate, come proposto da Moseley nel 1913, in base al numero atomico non noto ai tempi di Mendelèev (Henry Moseley, morto nel 1915 come militare in guerra a soli 28 anni).
Cronologia della scoperta degli elementi
Oggi esistono numerosi di tipi e forme di tabelle periodiche, talune estrose e accattivanti. Ciascuna di esse mette in luce determinate caratteristiche periodiche oppure esalta in modo più o meno evidente le proprietà dei gruppi o dei singoli elementi sfruttando accuratamente numeri e colori. L'esempio di tabella periodica che segue, aggiornata al 2010 (anno del Copernicio), mette in evidenza, mediante l'uso dei colori, lo stato fisico dei singoli elementi. All'interno delle caselle vengono visualizzati solo i simboli degli elementi, il loro numero atomico è l'eventuale presenza di isotopi radioattivi.

Relazione tra la configurazione elettronica e tabella periodica
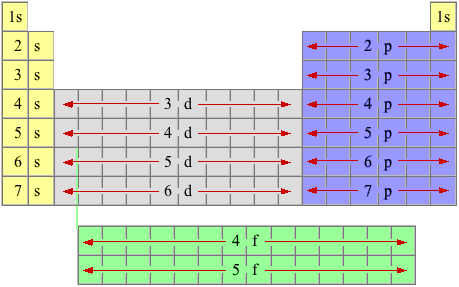
| TABELLA ORDINATA a blocchi secondo il riempimento dei sottolivelli quantici s, p, d, f |
|
- Il numero quantico principale degli orbitali di tipo "s" e "p" è identico a quello del periodo (riga) in cui si trovano. (es. l'orbitale "2s" si trova al secondo periodo e gli orbitali "3p" si trovano al terzo periodo).
- Il numero quantico principale degli orbitali di tipo "d" è di una unità inferiore rispetto al periodo in cui si trovano. (es. gli orbitali "3d" sono nel quarto periodo).
- Il numero quantico principale degli orbitali di tipo "f" è di due unità inferiore rispetto al periodo in cui si trovano. Per problemi di spazio, gli elementi con elettroni esterni negli orbitali di tipo "f" (Lantanidi e Attinidi) sono posizionati all'esterno per non allungare troppo la tabella periodica. (es. gli orbitali "4f" sono nel sesto periodo).
Rappresentazione visuale dell'aufbau e delle configurazioni elettroniche (.HTML)
Alcuni modi "colorati" per illustrare la tabella periodica permettono di raggruppare e/o visualizzare vistosamente alcune caratteristiche degli elementi chimici:
IUPAC originale (anno 2002, non più rintracciabile presso IUPAC)
IUPAC originale (anno 2004, file PDF, link locale)
IUPAC da me colorata (da originale anno 2010, al passaggio del cursore nome in ITA e ENG)
IUPAC originale (anno 2013, file PDF, link locale)
IUPAC originale (anno 2016, file PDF, link locale)
IUPAC originale (anno 2022, file PDF, link locale)
Archivio IUPAC (link presso IUPAC. Si trovano le tabelle IUPAC dal 2003 a quella attuale)
Mix di blocchi e periodi
Altre tabelle
Sistema periodico molto LUNGO:
( HTML )
I nomi degli elementi e loro origine (link esterno)