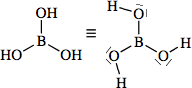
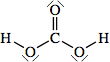
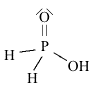
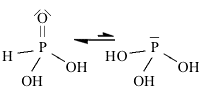
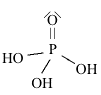
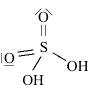
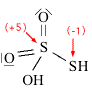
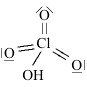
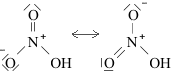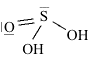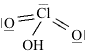Strutture di Lewis di alcuni acidiPer scrivere la formula di struttura di un acido ossigenato secondo la terminologia di Lewis si deve considerare il non metallo come elemento centrale. In linea di principio teniamo presente che gli idrogeni protici sono essenzialmente quelli legati all'ossigeno (gruppi -OH) e non quelli legati direttamente al non metallo. I rimanenti atomi si legheranno all'elemento centrale nel rispetto della sua configurazione elettronica esterna (che dovrebbe esservi nota). Come esempio prendiamo in considerazione l'acido carbonico
(H2CO3). Si tratta di un
acido diprotico e l'elemento centrale è il carbonio (C: 2s2 2p2). Si notino i due elettroni accoppiati sull'atomo di carbonio, da adesso in poi indicheremo una coppia di elettroni con una lineetta corta: Procediamo completando la formula con gli ossigeni rimanenti (solo uno) e lo leghiamo all'elemento centrale tramite doppio legame. 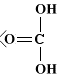 Per formare il doppio legame con il carbonio, l'ossigeno usa due elettroni dei sei presenti nell'ultimo livello; gli altri quattro, non impegnati in legame, li indichiamo come due coppie di elettroni utilizzando la consueta lineetta corta. Tornando un poco indietro nelle nostre conoscenze, ci ricordiamo che il carbonio forma doppi legami se ibridizzato sp2 e che, in tal caso, presenta angoli di legame di 120° disposti su un piano. Ci sembra quindi opportuno aggiustare ulteriormente la nostra struttura fornendo una geometria più consona alla presenza del doppio legame: 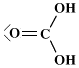
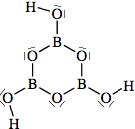
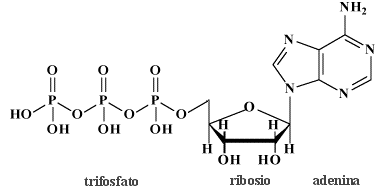
Come già detto nella parte di nomenclatura, gli acidi cosiddetti piro (dovreste chiamarli di-) come ad esempio l'acido pirosolforico (disolforico), l'acido pirocromico (dicromico), l'acido pirofosforico (difosforico) etc., sono derivati da due molecole di acido per perdita di una molecola di acqua. Come primo esempio illustriamo l'acido disolforico; 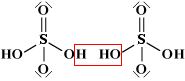 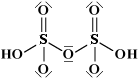 Prendiamo ora in considerazione la condensazione di due molecole di acido fosforico: 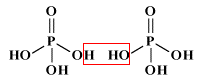 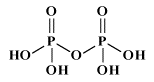 Se si condensa una ulteriore molecola di acido si avrà l'acido trifosforico: 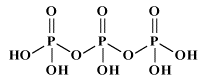 Questo acido, se condensato al "ribosio" e alla base purinica "adenina", costituisce la molecola dell'ATP: 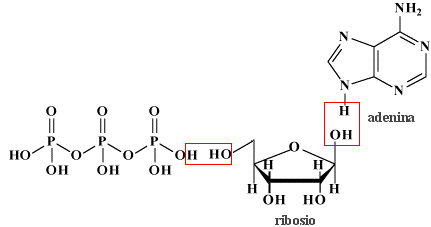
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
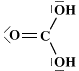
 Formule di Lewis di alcuni
acidi;
Formule di Lewis di alcuni
acidi;