Consideriamo un sale che sia abbastanza poco solubile (ad esempio il solfato di calcio, un sale che in laboratorio si conserva come sale diidrato) e supponiamo di essere in un ambiente a temperatura costante (es. 25°C). Adesso aggiungiamo gradualmente piccole quantità di sale (es. porzioni di 220 mg) ad un litro si acqua (il nostro solvente principe) avendo la pazienza di aspettare la sua solubilizzazione, magari aiutando il fenomeno mediante agitazione. Le prime aggiunte conducono alla completa solubilizzazione del sale e la fase solidà scompare completamente. Dalla quarta aggiunta in poi si nota che il sale non si solubilizza più e rimane il cosiddetto "corpo di fondo" anche quando si aspetta un poco dopo l'agitazione. Evidentemente si è raggiunto il limite di solubilità del sale in questione. Nella pratica può rimanere una certa opalescenza dovuta alle piccole particelle che fluttuano a causa della loro leggerezza sospinte dai moti termici convettivi.
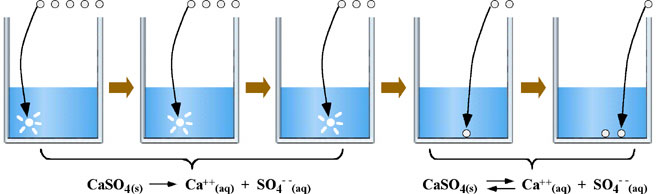
Nei primi tre passaggi il sale si scioglie completamente con la scomparsa della fase solida e altrettanto completamente viene dissociato dal solvente in ioni calcio e solfato; ho indicato la completezza del processo di solubilizzazione con una singola freccia. A partire dal quarto passaggio in poi, una qualunque ulteriore aggiunta di sale rimarrà indisciolto. Quello che succede, in realtà, è lo stabilirsi di un equilibrio dinamico tra la quantità di sale che si solubilizza e quello che contemporaneamente precipita riformando nella fase solida. In pratica, se siamo a temperatura costante e non esiste nessuna altra specie in soluzione, la quantità di sale disciolto e dissociato è quello della cosiddetta "soluzione satura".
Come abbiamo fatto nell'equilibrio di autoprotolisi dell'acqua, la costante di equilibrio relativa al nostro sistema includerà solo le specie in soluzione considerando invarianti le concentrazioni (o meglio le attività) della specie in fase solida. Pertanto, nel caso descritto dell'equilibrio di solubilità del solfato di calcio avremo che la costante relativa all'equilibrio di precipitazione e solubilizzazione assumerà la seguente espressione:
| Kps = [Ca2+] . [SO42–] |
Il significato dell'espressione precedente può essere così riassunto: il prodotto della concentrazione degli ioni ottenuti dalla solublizzazione, ciascuno elevato al proprio coefficiente stechiometrico, può assumere un valore massimo che indichiamo come Kps. Il Kps varia al variare della temperatura ed è specifico per ogni sostanza relativamente al solvente utilizzato.
L'espressione che esprime la relazione tra il prodotto ionico e il Kps dipende dalla stechiometria del processo, mentre il valore stesso del Kps rimane fissato, a una certa temperatura, come funzione della specie chimica interessata. Bisogna ammettere che il valore del Kps relativo alle concentrazioni differisce da quello ottenuto in termini di attività e la differenza è tanto più marcata tanto più elevate sono le concentrazioni che si riesce ad ottenere in soluzione: vale a dire tanto più elevata è la solubilità della specie chimica.
Nel caso particolare del solfato di calcio, trattandosi di un sale sufficientemente solubile, la differenza risulta notevole. Nel nostro corso, comunque, useremo i valori sperimentali relativi alle concentrazioni.
In base a quanto detto, si evince che deve esserci una stretta relazione tra la solubilità della specie chimica e il valore del suo Kps. Tale relazione si ottiene facilmente seguendo alcune semplici considerazioni.
Indichiamo con "s" la quantità di sostanza che si scioglie, esprimendola in moli di soluto per ogni litro di soluzione (mol dm-3, ovvero un termine di concentrazione). Per ogni quantità "s" di sostanza che si scioglie (che indicheremo con "s -->" sotto la formula della sostenza) si formeranno conseguentemente un quantità di ioni pari al rapporto stechiometrico esistente tra la specie solida e gli ioni prodotti.
Nel caso del solfato di calcio o di un semplice alogenuro di argento (AgCl, AgBr etc.), tale relazione di tipo 1:1, pertanto se "s -->" è la quantità di sale solido che si scioglie (in mol dm-3), saranno ancora "s" le quantità di [Ca2+] e di [SO42–] che si avranno in soluzione:
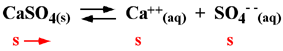 |
Sostituendo "s" nei giusti termini di concentrazione nell'espressione del prodotto di solubilità avremo
| Kps = [Ca2+] . [SO42–] = s . s = s2 |
La relazione ottenuta è valida per tutte le specie chimiche con lo stesso rapporto stechiometrico. Nel caso specifico del solfato di calcio:
Di seguito descriveremo dei casi con rapporto stechiometrico diverso da 1:1. La sequenza degli esempi prevede il cloruro di piombo(II), l'idrossido di alluminio e il fosfato di calcio.
| Kps = [Pb2+] . [Cl–] 2 |
Per mettere in relazione il Kps con la solubilità del sale dobbiamo considerare la stechiometria del processo. Indicando con "s-->" la quantità di sale solido che si scioglie (in mol dm-3), sarà "s" la concentrazione di ioni piombo, mentre la concentrazione di ioni cloruro sarà il doppio, cioè "2s":
Sostituendo "s" e "2s" nei giusti termini di concentrazione nell'espressione del prodotto di solubilità avremo (fate attenzione perchè il termine che andiamo a sostituire è la concentrazione, gli eventuali esponenti mantengono la loro funzione):
| Kps = [Pb2+] . [Cl–] 2 = s . (2 s)2 = 4 s3 |
| Kps = [Al3+] . [OH–] 3 |
Per mettere in relazione il Kps con la solubilità del sale dobbiamo considerare la stechiometria del processo. Indicando con "s-->" la quantità di sale che si scioglie (in mol dm-3), sarà "s" la concentrazione di ioni Al3+, mentre la concentrazione di ioni idrossido sarà il triplo, cioè "3s":
Sostituendo "s" e "3s" nei giusti termini di concentrazione nell'espressione del prodotto di solubilità avremo:
| Kps = [Al3+] . [OH–] 3 = s . (3 s)3 = 27 s4 |
| Kps = [Ca2+] 3 . [PO43–] 2 |
Per mettere in relazione il Kps con la solubilità del sale dobbiamo considerare la stechiometria del processo. Indicando con "s-->" la quantità di sale che si scioglie (in mol dm-3), sarà "3s" la concentrazione di ioni calcio, mentre la concentrazione di ioni fosfato sarà "2s":
Sostituendo "3s" e "2s" nei giusti termini di concentrazione nell'espressione del prodotto di solubilità avremo:
| Kps = [Ca2+] 3 . [PO43–] 2 = (3 s)3 . (2 s)2 = 108 s5 |
Abbiamo già visto un esempio di idrossido poco solubile. Due casi tipici sono l'idrossido di calcio e l'idrossido di magnesio. Queste due sostanze in particolare hanno una solubilità sufficiente ad alterare significativamente il pH di una soluzione acquosa. Si consideri ad esempio l'idrossido di calcio.
| Kps = [Ca2+] . [OH–] 2 = s . (2 s)2 = 4 s3 |
La soluzione satura di idrossido di calcio, a 25°C, ha una solubilità pari a:
| Pertanto | [OH–] = 2 s = 2 . 1.17 × 10-3 = 2.34 × 10-3 mol dm-3 | |
| Segue | pOH = 2.63; pH= 11.37 |
La presenza o l'aggiunta di una specie che produce uno ione a comune in soluzione tende, nella gran parte dei casi, a diminuire la solubilità di una sostanza poco solubile, in ossequio al principio di Le Chatelier. Il calcolo preciso della nuova solubilità, specie se la stechiometria del processo è complessa, può prevedere la soluzione di equazioni di grado superiore a 2, eseguibili facilmente mediante metodi iterativi. Negli esercizi che proporremo nei nostri esami daremo sempre la possibilità di effettuare semplificazioni tali da poter eseguire il calcolo senza l'ausilio di un computer dotato di programmi specifici.
Cominciamo con un esempio semplice: Il cloruro di argento in presenza o con aggiunta di cloruro di sodio.
Analizziamo il processo a partire da una soluzione satura di cloruro di argento a cui aggiungiamo del cloruro di sodio alla concentrazione "Cs". Il cloruro di sodio si scioglierà completamente e fornirà in soluzione una quantità di ioni cloruro, lo ione a comune, alla stessa concentrazione "Cs". La nuova solubilità che andiamo a determinare coincide ovviamente con quella del cloruro di argento in una soluzione di cloruro di sodio con concentrazione "Cs".
AgCl (s) 
Ag+(aq) + Cl -(aq) equil. iniziale s 
s s add NaCl - - Cs reagiscono - x x si formano x - - new equilibrio solido + x s - x s + Cs - x indico: s 1 = s - x s 1 s 1 + Cs
| Kps = [Ag +] . [Cl –] = s 1 . (s 1+ Cs) | (1) | |
| pertanto | s 12 + Cs . s 1 - Kps = 0 |
La soluzione dell'equazione fornisce il valore della nuova solubilità. Nel caso in cui s1 Ŕ trascurabile rispetto a "Cs" l'espressione (1) si riduce a
| Kps = s 1 . Cs | ||
| da cui | s 1 = Kps / Cs |
Consideriamo adesso un altro caso con una stechiometria di dissociazione diversa: lo ioduro di piombo(II) in presenza dello ione a comune "ioduro" prodotto dallo ioduro di potassio alla concentrazione "Cs".
PbI2 (s) 
Pb2+(aq) + 2 I -(aq) equil. iniziale s s 2 s add KI - - Cs reagiscono - x 2 x si formano x - - new equilibrio solido + x s - x 2 s + Cs - 2 x indico: s 1 = s - x s 1 2 s 1 + Cs
| Kps = [Pb 2+] . [I –] 2 = s 1 . (2 s 1+ Cs) 2 | (2) | |
| pertanto | 4 . s 13 + 4 . Cs . s 12 + Cs 2 . s 1 - Kps = 0 |
La soluzione reale dell'equazione di terzo grado completa fornisce il valore della nuova solubilità. Nel caso in cui 2s1 Ŕ trascurabile rispetto a "Cs" l'espressione (2) si riduce a
| Kps = s 1 . Cs 2 | ||
| da cui | s 1 = Kps / Cs 2 |
Quello che abbiamo chiamato "effetto dello ione a comune", come abbiamo già detto, è una semplice applicazione del principio di Le Chatelier. La conseguenza dell'effetto dello ione a comune è quella di ridurre la solubilità della sostanza poco solubile. In certi casi, però, un eccesso notevole dello ione a comune può condurre alla formazione di nuove sostanze (es. ioni "complessi") che alterano completamente il sistema chimico; in questi casi il sistema dovrà essere studiato in maniera completamente diversa, in virtù di equilibri multipli (simultanei) che si verrebbero a realizzare in soluzione. Per mantenerci nei limiti del nostro programma eviteremo l'argomento.
Se proviamo a sciogliere un idrossido poco solubile (quelli del secondo gruppo o dei metalli di transizione), in soluzione acquosa si formano ioni idrossido. L'aggiunta a queste soluzioni sature di una base forte come KOH o NaOH produce lo ione a comune OH– e la conseguente riduzione della solubilità può essere studiata come nei casi precedenti. L'aggiunta di un acido forte, invece, tende a ridurre la concentrazione di ioni idrossido formando acqua. L'effetto che ci aspettiamo, in questi casi, è uno spostamento dell'equilibrio di solubilità verso destra, cioè verso una maggiore solubilizzazione della specie solida. Tutti gli idrossidi poco solubili tendono ad aumentare la loro solubilità per aggiunta di acidi forti. Il calcolo della nuova solubilità implica l'utilizzo di equilibri multipli: equilibrio di solubilità + equilibrio autoprotolisi dell'acqua. Se però si riesce a fissare il pH mediante tamponi efficaci, o le aggiunte di base forte vengono fatte fino a realizzare un ben preciso valore di pH misurato mediante opportuni pH-metri, il calcolo viene estremamente semplificato perchè il valore di [OH–] risulta noto e lo chiameremo [OH–]1.
Me(OH)n (s) 
Men+(aq) + n OH -(aq) eq. iniziale s s s add [H3O+] - - [H3O+] scompaiono [OH -] - - y si formano (sciolgono) - x x new equilibrio solido - x s + x s - y + x indico: s 1 = s + x s 1 [OH-]1
| Kps = [Men+] . [OH–] n = s 1 . [OH-]1n | ||
| da cui | s 1 = Kps / [OH-]1n |
Più in generale la solubilità di una specie poco solubile può essere aumentata se in qualche modo si elimina dall'ambiente une delle specie che partecipa all'equilibrio di solubilità, ad esempio introducendo nell'ambiente una sostanza in grado di reagire con essa.
In realtà anche l'aggiunta di un sale senza ioni a comune e che non reagisce in alcun modo con gli ioni derivanti dalla sostanza poco solubile, tende ad aumentare la solubilità per il cosiddetto "effetto sale". L'effetto sale consiste nel fatto che l'incremento della forza ionica della soluzione altera l'attività di tutti gli ioni ma soprattutto riduce la velocità di ricombinazione di ioni con segno opposto. L'effetto sale è meno rilevante, a parità di concentrazione, rispetto all'effetto dello ione a comune.
Quando in soluzione si vengono a trovare ioni che possono dar luogo ad una sostanza poco solubile, se il prodotto ionico, nella corretta espressione in funzione della stechiometria della specie poco solubile, supera il valore previsto per il Kps, la soluzione "sovrassatura" si trova in una condizione metastabile che precede la formazione della separazione in fase solida della sostanza poco solubile. Si dice che la sostanza "precipita" ma vi prego di non interpretare la parola in puro italiano, infatti la stratificazione sul fondo del recipiente può avvenire anche molto lentamente a causa della piccola dimensione delle particelle solide che spesso si formano.
Supponiamo, ad esempio, di miscelare una soluzione di cloruro di sodio con una soluzione di nitrato di argento. I due sali in questione sono entrambi molto solubili in acqua ove risultano praticamente completamente dissociati in ioni.
|
NaCl |
|
AgNO3 |
Se il prodotto della concentrazione degli ioni cloruro e argento, avendo cura di tener conto della diluizione a causa del maggior volume della soluzione risultante, supera il valore del prodotto di solubilità Kps del cloruro di argento, diventa possibile la precipitazione del sale poco solubile.