Lo stato gassoso (seconda parte)
Modello, in sintesi, del gas ideale
- PARTICELLE puntiformi (dimensioni assolutamente trascurabili)
- PARTICELLE in continuo movimento (dotate di energia cinetica)
- ASSENZA DI INTERAZIONI (assenza di termini di energia potenziale, distanza media elevata, si prescinde dalla natura chimica del gas)
- URTI ELESTICI ED ISTANTANEI (sia con altre particelle che contro le pareti)
Leggi dei gas ideali
 Robert Boyle (1629-1691) |
 Jacques Charles (1746-1823) |
 Joseph Louis Gay-Lussac (1778-1850) |
|
(PV)t = cost P1V1 = P2V2 |
isoterma | T = cost |
|
Pt = PO(1+α t) P = (P0/T0)T |
isocora | V = cost |
|
Vt = VO(1+α t) V = (V0/T0)T |
isobara | P = cost |
|
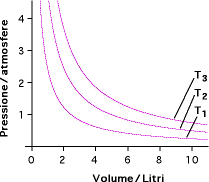
Rappresentazione della legge di Boyle (isoterma) per
un gas, a tre diverse temperature
|
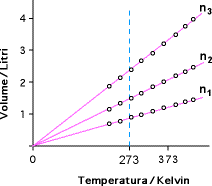
Rappresentazione delle isobare per tre diverse quantità di gas
|
 |
 |
L'equazione di stato dei Gas Ideali
Combinando opportunamente le singole leggi dei gas o mediante la cosiddetta teoria cinetica dei gas, è possibile ricavare l'equazione di stato dei gas ideali
|
P V = n R T
|
nella quale R è la costante universale dei gas. Per una corretta applicazione dell'equazione bisogna prestare attenzione nell'utilizzare i dati nelle unità di misura confacenti al valore di R utilizzato:
(valore approssimato)
(valore più preciso)0.0821 L atm K-1 mol-1 0.08205746 1.987 cal K-1 mol-1 1.987171 8.314 J K-1 mol-1 8.314472
Nella Chimica di base in genere viene utilizzato il primo valore di
R, per cui nell'equazione di stato la pressione dovrà essere espressa
in atmosfere, il volume in litri, n in moli e
la temperatura in Kelvin.
Il termine (Litri atmosfere) rappresenta una quantità di energia è pertanto può essere definita anche in calorie o in Joule. Da queste ultime definizioni derivano gli altri due valori proposti per il valore di R.
Già da parecchio tempo il valore di R più utilizzato è il terzo perchè riferito ad unità internazionali; in questo caso bisogna tenera presente che nell'equazione di stato (e anche nella simile equazione della pressione osmotica) la pressione dovrà essere espressa in Pascal ed il volume in metri cubi (per n e la temperatura ovviamente si continua ad usare le unità che già appartenevano al sistema internazionale).
L'equazione di stato dei gas ideali include anche il principio di Avogadro: volumi uguali di gas diversi, nelle stesse condizioni di temperatura e pressione, contengono lo stesso numero di molecole. Infatti se il comportamento dei gas è ideale, il valore di n, se oltre a T e P sono uguali anche i volumii sarà ovviamente lo stesso.
| n | = | P V R T |
Definizioni:
Condizioni normali o Standard: la normalizzazione,
utilizzata per i gas, consiste nell'utilizzo della
temperatura di 273.15 K (0°C) e della pressione di una
atmosfera. L'ultima raccomandazione IUPAC sconsiglia di utilizzare il valore di una atmosfera e di sostituirlo con quello di un Bar.
Condizioni Standard (Wiki ITA) (link originale su internet)
Standard Condition (Wiki ENGLISH) (link originale su internet)
Volume molare: volume occupato da una mole (generico)
Volume molare a condizioni normali o Standard: volume occupato da una mole di gas ideale in condizioni standard. Il precedente standard prevedeva 273.15 K (0°C) e 1 atmosfera, l'attuale standard prevede 273.15 K (0°C) e 100000 Pa (corrispondenti ad 1 bar del vecchio sistema CGS)
| VM(c.n.) | = | n R T P |
= | 1*8.3145*273.15 101325 |
= 0.022414 m3 = 22.414 Litri a 273.15 K (0°C) e 1 atm |
| VM(c.n.) | = | n R T P |
= | 1*8.3145*273.15 100000 |
= 0.022711 m3 = 22.711 Litri a 273.15 K (0°C) e 1 bar |
Legge di Dalton delle pressioni parziali
Si supponga di avere, in un contenitore termostatato alla temperatura T, una miscela di tre gas ideali. Ciascuno di essi occupa l'intero volume V del recipiente ed esercita una certa pressione, detta "pressione parziale", funzione del numero di moli con cui il gas partecipa nella miscela (distinguiamo i tre gas mediante numerazione sequenziale):
| (1) | P1V = n1 R T (per il gas 1) | ||||||||||
| (2) | P2V = n2 R T (per il gas 2) | ||||||||||
| (3) | P3V = n3 R T (per il gas 3) | ||||||||||
| Sommando membro a membro | |||||||||||
| (4) | (P1 + P2 + P3) V = (n1 + n2 + n3) R T | ||||||||||
| indicando con Pt la pressione totale risultante e con nt il numero di moli totali: | |||||||||||
| (5) | PtV = nt R T (per la miscela dei tre gas) | ||||||||||
| Dividendo la (1) per la (5) | |||||||||||
|
|||||||||||
ove con χ 1 si intende la frazione molare
del gas (1) rappresentativa del contributo percentuale in moli del gas (1) nella miscela e con P1 la sua pressione parziale.
Espressioni analoghe si ottengono per gli altri componenti la miscela mediante lo stesso procedimento, cioè dividendo la (2) e la (3) sempre per la (5).
|
|||||||||||
|
La somma di tutte le singole frazioni molari di una miscela deve fornire la quantità unitaria (100% delle moli presenti). Nel caso dell'esempio proposto:
| χ 1 + χ 2 + χ 3 = | n 1 n t |
+ | n 2 n t |
+ | n 3 n t |
= |
n 1 + n 2 + n 3
n t |
= | n t n t |
= 1 |