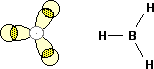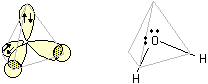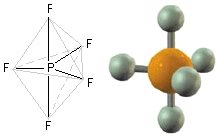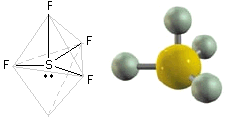Configurazione sterica di alcune molecole
NOTE:
Alcune sostanze illustrate negli esempi che seguono, se considerate allo stato liquido o solido, possono assumere configurazioni ben diverse da quelle previste allo stato gassoso o nella forma monomerica.
Alcuni elementi tendono a formare, di preferenza, legami di particolare geometria giustificate da un certo tipo di ibridazione; in situazioni diverse, quegli stessi elementi, possono comportarsi in maniera diversa e assumere geometrie di altra natura.
Molti autorevoli autori criticano la partecipazione degli orbitali d nella formazione dei legami in PF5 o SF6 etc. utilizzando orbitali molecolari ma noi qui spiegheremo la geometria assunta da tali molecole mediante l'ibridazione sp3d o sp3d2.
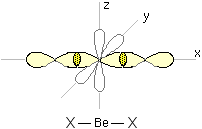
BeCl2 , BeH2 (forme monomeriche gassose)
Le molecole hanno struttura lineare come dimostrato
dall'assenza di momento dipolare. La forma di queste
molecole è giustificata dall'ibridazione sp del
berillio.
Si può pensare ad una promozione di un elettrone
dall'orbitale 2s ad un orbitale 2p e successiva
ibridazione. Tutti questi
processi richiedono energia, recuperata in ragione della
maggiore stabilità del prodotto che si viene a
formare.
Si noti che gli orbitali py e pz,
rappresentati bianchi con un contorno grigio, non risultano
occupati da alcun elettrone.
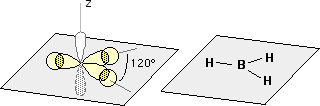
BH3 (forma monomerica) , BF3
NOTA: BH3 usualmente è un dimero, esiste in forma monomerica in particolari solventi. Tutti gli alogenuri del boro sono monomerici (non quelli di alluminio che risultano monomerici solo ad alta temperatura).
Le molecole hanno struttura planare, con il boro al centro di un triangolo equilatero (trigonale planare). La forma di queste molecola può essere giustificata ipotizzando l'ibridizzazione sp2 del boro. Anche in questo caso, data la configurazione elettronica del boro, è necessario considerare la promozione di un elettrone 2s verso l'orbitale 2p e successiva ibridazione.
L'orbitale pz, rappresentato bianco con un contorno grigio, non risulta occupato da alcun elettrone.
 |
|
|
Vista prospettica del modello molecolare JSmol view |
Vista dall'asse z |
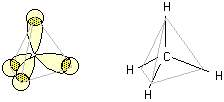
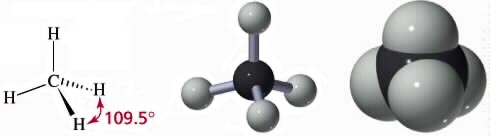
CH4 (gas), CCl4 (liquido)
La molecola del gas metano ha una struttura detta "tetraedrica" con il carbonio al centro e i quattro atomi di idrogeno diretti lungo i vertici di un tetraedro apparente. La forma geometrica di questa molecola può essere giustificata ipotizzando l'ibridizzazione sp3 del carbonio.
In una prima fase, si può considerare la promozione
di un elettrone 2s verso l'orbitale 2p ancora privo di
elettroni e, in seguito, l'ibridazione dell'orbitale s con i
tre orbitali p.
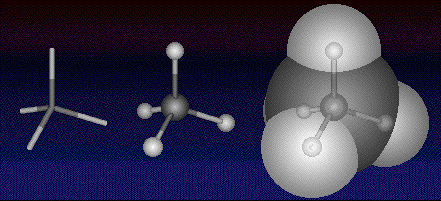
Nella figura seguente la molecola del metano viene rappresentata rispettivamente come formula prospettica, come modello tridimensionale ball-and-stick e come modello space-filling.
Nella figura seguente, abbastanza suggestiva, il metano viene rappresentato come modello tridimensionale stick, come ball-and-stick e come space-filling trasparente.
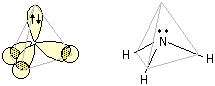
NH3 (gas)
L'atomo di azoto, nella sua configurazione fondamentale ha tutti gli orbitali 2s e 2p occupati da almeno un elettrone, pertanto l'ibridazione può avvenire senza la necessità di promozione. L'ibridazione sp3 da luogo a quattro orbitali degeneri, diretti ai vertici di un tetraedro apparente, uno di loro è occupato da due elettroni. Gli elettroni che si impegnano in legame sono solamente quelli spaiati. La struttura dell'ammoniaca, considerando i nuclei atomici costituenti la molecola, è quella di una piramide a base triangolare.
Nella figura seguente la molecola dell'ammoniaca viene rappresentata rispettivamente come formula prospettica con il doppietto (Lone pair) in evidenza e come modello tridimensionale ball-and-stick
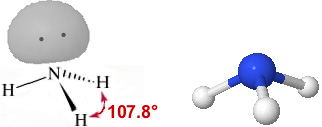
L'angolo di legame H-N-H non è quello perfettamente tetraedrico (109.5°), ma risulta inferiore a causa del maggiore dominio del doppietto elettronico non impegnato in legame rispetto a quello dei doppietti di legame.
H2O
L'atomo di ossigeno, nella sua configurazione fondamentale ha tutti gli orbitali 2s e 2p occupati da elettroni, pertanto il processo di ibridazione, come visto per l'azoto, può avvenire senza la necessità di promuovere elettroni. L'ibridazione sp3 da luogo a quattro orbitali degeneri, diretti ai vertici di un tetraedro apparente, e gli elettroni che si impegnano in legame sono solamente i due spaiati. La struttura dell'acqua, considerando i nuclei atomici costituenti la molecola, è angolare con l'atomo di ossigeno al vertice centrale legato ai due atomi di idrogeno.
Nella figura seguente la molecola dell'acqua viene rappresentata rispettivamente come formula prospettica con i due doppietti in evidenza e come modello ball-and-stick
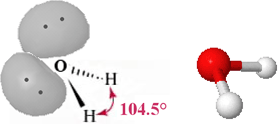
L'angolo di legame H-O-H non è quello perfettamente tetraedrico (109.5°), ma risulta ancora minore rispetto a quello già visto nel caso precedente a causa della presenza di ben due doppietti elettronici non impegnati in legame.
Metano, acqua e ammoniaca: Strutture con geometria di riferimento "Tetraedrica" a confronto
Link interattivo "OnMouseOver" HTML
Link interattivo "OnMouseOver" JSmol
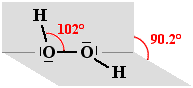
H2O2
Per l'acqua ossigenata (perossido di idrogeno) valgono le stesse premesse illustrate nel caso dell'acqua. I due atomi di ossigeno si possono considerare ibridizzati sp3. La struttura non è planare a causa della reciproca repulsione dei doppietti elettronici non impegnati in legame presenti nei due atomi di ossigeno che causano una certa barriera rotazionale. La molecola tende a disporsi a catena obliqua ("gauche") sistemandosi su due piani che si intersecano come un foglio aperto con angoli perfettamente definiti solo in fase solida. Nella fase liquida o in fase soluzione si hanno tutta una serie di situazioni intermedie tra gli estremi qui sotto proposti:
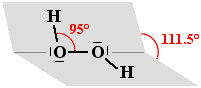 |
 |
H2O2 in fase gassosa |
H2O2 in fase solida |
La distanza di legame O-O nell'acqua ossigenata è circa di 1.4 Å, maggiore di quella presente nel diossigeno (circa 1.2 Å) nel quale si considera presente un doppio legame.
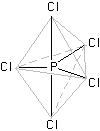
PCl5, PF5
il pentacloruro di fosforo è un solido cristallino giallo pallido di formula [PCl4]+ [PCl6]- che a circa 160°C vaporizza dando molecole monomere di PCl5. il pentaflururo, in condizioni ordinarie, è un gas parecchio denso.
La geometria di queste molecole pone i leganti al fosforo ai vertici di una bipiramide a base triangolare. Il fosforo occupa il centro del triangolo. Questo è un esempio di ibridizzazione sp3d. Il fosforo ha la stessa struttura elettronica esterna dell'azoto, ma l'ultimo livello energetico per gli elettroni nell'atomo di fosforo è n=3, sono pertanto disponibili, anche se vuoti, gli orbitali 3d. La promozione avviene in maniera tale da ridistribuire gli elettroni in modo che un orbitale 3d risulti occupato, segue l'ibridizzazione sp3d che presenta appunto la geometria a bipiramide trigonale:
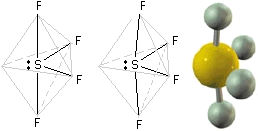
SF4 (gas)
Gas corrosivo e pericoloso perchè rilascia facilmente HF. La geometria della molecola del tetrafluoruro di zolfo è un poco particolare, anche se sfrutta la forma base di una bipiramide trigonale. Lo zolfo occupa il centro della possibile bipiramide, ma forma solo quattro legami invece che i cinque necessari al completamento della suddetta geometria. Anche questo, come il precedente caso del PF5-PCl5, è un esempio di ibridizzazione sp3d. Lo zolfo ha la stessa struttura elettronica esterna dell'ossigeno, ma l'ultimo livello energetico per gli elettroni nell'atomo di zolfo è n=3, sono pertanto disponibili, anche se vuoti, gli orbitali 3d. Si verifica la promozione di un elettrone 3p a 3d, segue l'ibridizzazione sp3d che presenta appunto la geometria di bipiramide trigonale:
Come si può notare, un orbitale ibrido risulta occupato da una coppia di elettroni di non legame. Essa può essere disposta in posizione assiale o equatoriale:
Entrambe le geometrie sono distorte, la più stabile risulta la seconda (Lone pair equatoriale) e la distorsione conduce da un angolo assiale F-S-F di circa 187°.
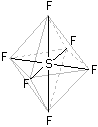
SF6
È un gas trasparente, privo di odore, non-tossico e non-infiammabile; ad 1 bar ha densità 6.164 g/L (circa 5.1 volte più denso dell'aria). La geometria di riferimento per questa molecola è quella di un ottaedro (bipiramide a base quadrata regolare). Lo zolfo occupa il centro del quadrato e i leganti sono disposti ai vertici dell'ottaedro. Questo è un esempio di ibridizzazione sp3d2. L'ultimo livello energetico per gli elettroni nell'atomo di zolfo è n=3, sono pertanto disponibili, anche se vuoti, gli orbitali 3d. La promozione avviene in maniera tale da ridistribuire gli elettroni in modo che due orbitali 3d risultino occupati, segue l'ibridizzazione sp3d2 che presenta appunto la geometria ottaedrica:
Doppio e triplo legame carbonio-carbonio
Il carbonio ha la particolarità di formare catene abbastanza lunghe attraverso legami carbonio-carbonio. Questo legame può essere, in linea generale, semplice, doppio e triplo.
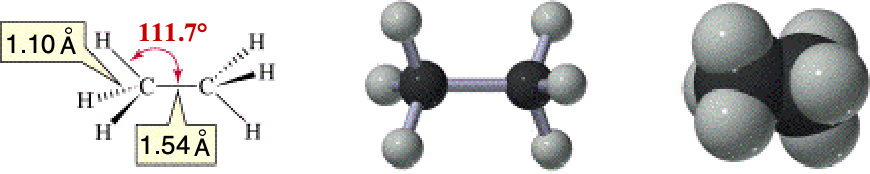
ETANO
(struttura tridimensionale in JSmol)
L'omologo successivo al metano (idrocarburi saturi)
è l'etano in cui il legame C-C è semplice con
gli atomi di carbonio ibridizzati sp3. A
temperatura ambiente la rotazione attorno a tale legame
è praticamente libera
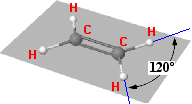
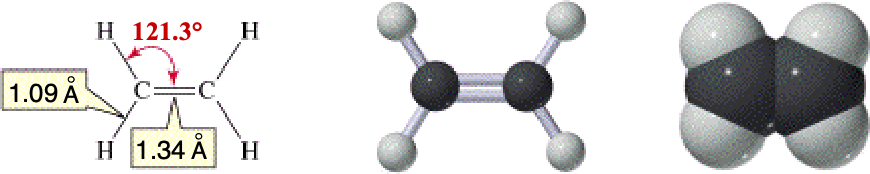
ETENE o etilene
(costruzione tridimensionale in JSmol)
Il più semplice idrocarburo con un doppio legame
è l'etilene C2H4 (etene). In
tale molecola ciascun atomo di carbonio è ibridizzato
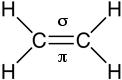
sp2 e il doppio legame consiste in un legame
sigma tra due orbitali ibridi e uno π tra i due orbitali pz non ibridizzati di ciascun
atomo di carbonio.
 |
 |
| Modello strutturale Ball&stick e nomale formula di struttura: evidenziano la planarità della molecola e gli angoli di 120° tipici dell'ibrididizzazione sp2 | |
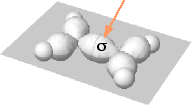 |
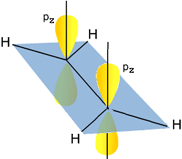
Orbitali ibridi sp2 dei due atomi di carbonio e orbitali 1s dei quattro atomi di idrogeo. Si noti la sovrapposizione sigma di due orbitali ibridi dei due atomi di carbonio lungo l'asse di legame |
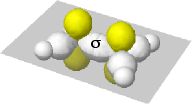 |
Qui evidenzio gli orbitali p non ibridizzati dei due atomi di carbonio, (brutalmente colorati di giallo), ciascuno occupato da un elettrone. Sono disposti su assi normali al piano della molecola |
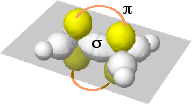 |
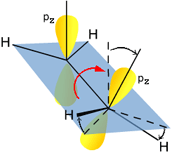
Possibilità di sovrapposizione laterale degli orbitali p non idridizzati |
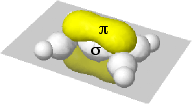 |
Sovrapposizione laterale degli orbitali p non idridizzati con formazione del legame π |
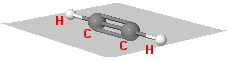
L'angolo di legame è pressocchè di 120°, tipico dell'ibridizzazione sp2. La libera rotazione attorno al legame C-C risulta impedita
La libera rotazione attorno al legame C-C risulta impedita a causa del doppio legame; una rotazione implicherebbe la rottura del legame trasversale dovuto alla sovrapposizione degli orbitali pz:
ETINO o acetilene
(costruzione tridimensionale in JSmol)
Il più semplice idrocarburo con un triplo legame
è l'acetilene C2H2 (etino). In
tale molecola ciascun atomo di carbonio è ibridizzato
sp e il triplo legame consiste in un legame sigma tra due
orbitali ibridi e due π rispettivamente tra i due orbitali pz e i due
orbitali py non ibridizzati di ciascun atomo di
carbonio.
 |
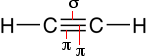 |
| Modello strutturale Ball&stick e normale formula di struttura: evidenziano la linearità della molecola e gli angoli di legame di 180° tipici dell'ibridizzazione sp. | |
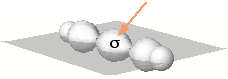 |
Orbitali ibridi sp dei due atomi di carbonio e orbitali 1s dei due atomi di idrogeno. Si noti la sovrapposizione sigma (indicata dalla freccia) dei due atomi di carbonio lungo l'asse di legame. |
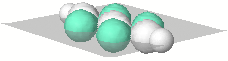 |
In evidenza, colorati in verdemare, gli orbitali p non ibridizzati dei due atomi di carbonio i cui assi risultano disposti sul piano scelto come riferimento. |
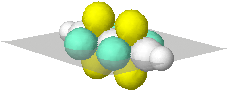 |
Colorati in giallo, sono visualizzati anche gli orbitali p non ibridizzati dei due atomi di carbonio i cui assi risultano normali al piano scelto come riferimento. |
 |
Sovrapposizione laterale degli orbitali p non ibridizzati disposti nel piano di riferimento con formazione di un legame π |
 |
Sovrapposizione laterale degli orbitali p non ibridizzati disposti normalmente al piano di riferimento con formazione di un ulteriore legame π |
Nella figura seguente la molecola dell'etino viene rappresentata rispettivamente come formula prospettica (lineare in cui vengono evidenziate le distanze di legame), come modello tridimensionale ball-and-stick e come modello space-filling

DIOSSIDO DI CARBONIO o anidride carbonica
(costruzione tridimensionale in JSmol)
In
questa molecola l'atomo di carbonio è ibridizzato sp (come nell'etino) mentre ciascun atomo di ossigeno è ibridizzato
sp2; invece di un triplo legame il carbonio forma due doppi legami con ciascun atomo di ossigeno e la molecola risulta lineare. I legami sigma si estrinsecano tra i due
orbitali ibridi del carbonio e l'orbitale sp2 di ciascun atomo di ossigeno contenente un solo elettrone. I due legami π derivano dalla sovrapposizione tra i due orbitali p non ibridizzati dell'atomo di
carbonio e l'orbitale "p" non ibridizzato di ciascun atomo di ossigeno. Affinché si possano formare i due doppi legami, gli orbitali p non ibridizzati degli atomi di ossigeno devono presentarsi nella stessa direzione dei due orbitali non ibridizzati del carbonio; ciò impone che i due "Lone Pair" costituiti dagli orbitali sp2 degli atomi di ossigeno vadano ad insistere su due piani tra loro ortogonali.
(O) n=2
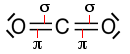 |
Formula di struttura: la molecola è lineare con angoli di legame di 180° tipici dell'ibridizzazione sp del carbonio. |
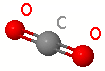 |
Carbonio (grigio scuro), Ossigeno (rosso). Rappresentazione Ball and Stick. |
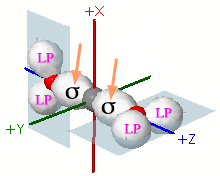 |
Le frecce indicano le sovrapposizioni sigma dei due orbitali ibridi sp del carbonio centrale con gli orbitali sp2 dei due atomi di ossigeno aventi un solo elettrone. Si noti la rotazione degli atomi di ossigeno che dispongono gli orbitali sp2 con due elettroni (Lone Pair) su piani ortogonali (in azzurro chiaro) |
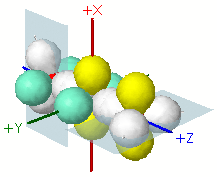 |
La rotazione degli atomi di ossigeno permette di posizionare il loro orbitale p non ibridizzato in condizione ottimale per la sovrapposizione π, distinguendo tra i due orbitali sp non ibridizzati dell'atomo di carbonio (verdemare con verdemare, giallo con giallo) |
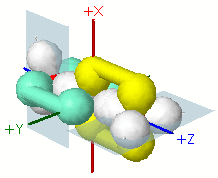 |
Sovrapposizione laterale (molto stilizzata) degli orbitali p non ibridizzati con formazione di due legami π |
NOTA: per le strutture relative agli acidi e relativi anioni elencati qui di seguito rivolgersi ai libri di testo o agli appunti personali trascritti in aula:
acido carbonico, anione carbonato, acido solforico, anione solfato, acido fosforico, anione fosfato.