TRATTAZIONE ONDULATORIA DEGLI ELETTRONI IN UN ATOMO
|
Il modello ondulatorio dell'elettrone consente
di stabilire le zone dello spazio attorno al nucleo
ove è massima la densità di carica
elettrica negativa. (Paolo Silvestroni, "Fondamenti di Chimica") |
(Erwin Schrödinger 1927)
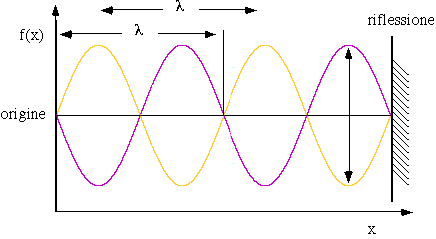
Nei fenomeni ondulatori di qualsivoglia natura è fondamentale la conoscenza dell'equazione d'onda, dell'equazione cioè che descrive l'ampiezza dell'onda stessa in funzione del tempo e della distanza da un punto stabilito come origine dell'onda. Nel caso delle onde stazionarie l'ampiezza dell'onda in ciascun punto è costante nel tempo e quindi essa è funzione solo della distanza
Equazione di Schrödinger rappresentata nella forma usuale:
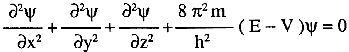
Somma delle derivate parziali seconde della funzione ![]() rispetto alle coordinate cartesiane x, y, z; E = energia
totale; V = energia potenziale
rispetto alle coordinate cartesiane x, y, z; E = energia
totale; V = energia potenziale
Espressione mediante l'operatore laplaciano:
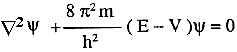
1) L'equazione di Schrödinger ammette, dal punto di vista matematico, infinite soluzioni, non tutte accettabili dal punto di vista fisico.
2) I valori di E per i quali l'equazione ha
soluzioni, si chiamano autovalori, le corrispondenti funzioni autofunzioni ![]() .
.
3) L'insieme delle soluzioni dell'equazione, può
essere scritta sotto forma di un'unica funzione:
![]() =
= ![]() (x, y, z, n, l, ml); x, y, z sono le
coordinate spaziali ed n, l, ml sono numeri
interi detti quantici.
(x, y, z, n, l, ml); x, y, z sono le
coordinate spaziali ed n, l, ml sono numeri
interi detti quantici.
4) Per ogni terna di numeri quantici, si ha una funzione
particolare ![]() (x, y,
z) che viene detta funzione d'onda orbitale od orbitale (
(x, y,
z) che viene detta funzione d'onda orbitale od orbitale (![]() )
)
5) L'espressione matematica ![]() dv rappresenta come varia la
probabilità di trovare l'elettrone nel volume
infinitesimo dv, nelle varie regione dello spazio attorno al nucleo. La certezza di trovare l'elettrone intorno al nucleo si ha quando l'integrale delle precedente espressione raggiunge il valore unitario (100%);
dv rappresenta come varia la
probabilità di trovare l'elettrone nel volume
infinitesimo dv, nelle varie regione dello spazio attorno al nucleo. La certezza di trovare l'elettrone intorno al nucleo si ha quando l'integrale delle precedente espressione raggiunge il valore unitario (100%);
6) La rappresentazione geometrica di un dato orbitale (che chiamerò forma orbitalica per differenziarla quanto più mi è possibile dalla funzione matematica orbitale) può essere visualizzata tracciando superfici comprendenti punti di uguale probabilità, che quindi individuano e limitano la regione dello spazio entro cui la probabilità di trovare l'elettrone, durante il suo moto, raggiunga un valore prossimo al 100% (usualmente il 90-95%).
7) Ogni soluzione matematica dell'equazione porta a definire l'energia totale del sistema nonché un'insieme di tre numeri quantici, rappresentati dalle lettere n, l, ml.