|
Modello atomico di Ernest Rutherford
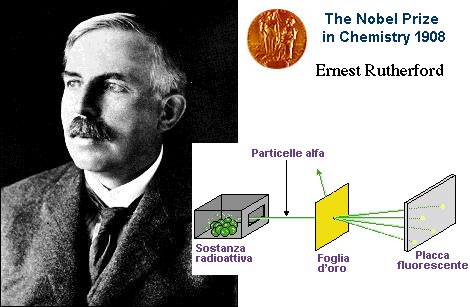 Il modello atomico di Rutherford, pur rappresentando
un notevole balzo in avanti, ebbe comunque vita breve, in quanto non si accordava
con altre osservazioni sperimentali: soprattutto non era in grado di giustificare
la stabilità degli atomi.
Atomi, elementi, isotopi 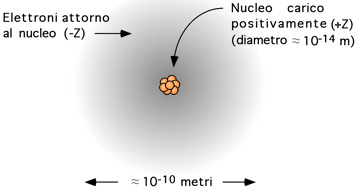
Il numero di protoni di un atomo si dice NUMERO ATOMICO e si indica con Z. La somma del numero di protoni e del numero di neutroni N (particelle pesanti del nucleo) si dice NUMERO di MASSA e si indica con A (A = Z + N). La seguente simbologia può essere utilizzata per descrivere un atomo di un particolare elemento x Un elemento è una sostanza i cui atomi hanno tutto lo stesso numero atomico, Z. Se si aggiunge o si sottrae un protone al nucleo, si ottiene un altro elemento. Se si addiziona o si sottrae un neutrone al nucleo, si ottiene un nuovo isotopo dello stesso elemento (isos topos = stesso posto). In un atomo neutro, il numero di protoni presenti nel nucleo (carichi positivamente) sono uguali al numero di elettroni orbitanti. Isotopi dell'idrogeno. Ecco i tre isotopi naturali dell'idrogeno: 
Se si addiziona un protone al nucleo dell'idrogeno, si ottiene un nucleo corrispondente ad un isotopo dell'elio. Di seguito vengono illustrati due comuni isotopi dell'elio: 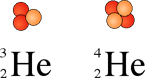
Siccome il simbolo di un elemento é in relazione diretta con il numero atomico, spesso quest'ultimo si omette e si utilizza solo il numero di massa per identificare un particolare isotopo (es 12C) La massa atomica tabulata è la media pesata (ponderata) delle masse dei vari isotopi in base alla ABBONDANZA NATURALE. Nel semplice caso dell'idrogeno, i due isotopi relativamente abbondanti sono 1H (99.985%) e il 2H (0.015%) PA (H) = %(1H) x massa(1H) + %(2H) x massa(2H) = Nel caso di atomi con numero atomico > 1, la presenza di un certo numero di protoni tutti carichi positivamente in uno spazio così ristretto potrebbe far pensare ad una grossa instabilità dei nuclei. La presenza dei neutroni, con i quali i protoni esercitano forze attrattive (forze nucleari forti) dovute ad energie di scambio, rende il nucleo stabile. In alcuni isotopi di certi elementi, nei quali il numero di neutroni eccede quello dei protoni, si manifesta una certa instabilità del nucleo che conduce alla cosiddetta radioattività. |
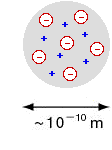 Dopo la scoperta dell'elettrone (1897, raggi catodici), J. J. Thomson (Joseph John Thomson, 1856 - 1940) propose un modello di atomo costituito da
una sfera piuttosto uniforme sulla quale si disponevano, appiccicati
come l'uvetta in un panettone, gli elettroni uniformemente distribuiti
sulla superfice. Non c'era un nucleo vero e proprio.
Dopo la scoperta dell'elettrone (1897, raggi catodici), J. J. Thomson (Joseph John Thomson, 1856 - 1940) propose un modello di atomo costituito da
una sfera piuttosto uniforme sulla quale si disponevano, appiccicati
come l'uvetta in un panettone, gli elettroni uniformemente distribuiti
sulla superfice. Non c'era un nucleo vero e proprio.