Lo stato gassoso
Modello, in sintesi, del gas ideale
- PARTICELLE puntiformi (dimensioni assolutamente trascurabili)
- PARTICELLE in continuo movimento (dotate di energia cinetica)
- ASSENZA DI INTERAZIONI (assenza di termini di energia potenziale, distanza media elevata, si prescinde dalla natura chimica del gas)
- URTI ELESTICI ED ISTANTANEI (sia con altre particelle che contro le pareti)
Leggi dei gas ideali
 Robert Boyle (1629-1691) |
 Jacques Charles (1746-1823) |
 Joseph Louis Gay-Lussac (1778-1850) |
|
(PV)t = cost P1V1 = P2V2 |
isoterma | T = cost |
|
Pt = PO(1+α t) P = (P0/T0)T |
isocora | V = cost |
|
Vt = VO(1+α t) V = (V0/T0)T |
isobara | P = cost |
|
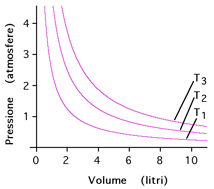
Rappresentazione della legge di Boyle per
un gas, a tre diverse temperature (T3>T2>T1)
|
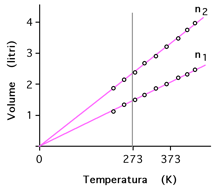
Rappresentazione della legge isobara
per due diverse quantità di gas (n2>n1)
|
 |
 |
L'equazione di stato dei Gas Ideali
Combinando opportunamente le singole leggi dei gas o mediante un opportuno sviluppo fisico-matematico del modello teorico descritto (teoria cinetica dei gas), è possibile ricavare l'equazione di stato dei gas ideali.
|
P V = n R T
|
nella quale R è la costante universale dei gas. Per una corretta applicazione dell'equazione bisogna prestare attenzione nell'utilizzare i dati nelle unità di misura confacenti al valore di R utilizzato:
(valore approssimato)
(valore più preciso)0.0821 L atm K-1 mol-1 0.08205746 1.987 cal K-1 mol-1 1.987171 8.314 J K-1 mol-1 8.314472
Nella Chimica di base in genere viene utilizzato il primo valore di
R, per cui nell'equazione di stato la pressione dovrà essere espressa
in atmosfere, il volume in litri, n in moli e
la temperatura in Kelvin.
Il termine (Litri atmosfere) rappresenta una quantità di energia che può essere definita in calorie o Joule.
In Chimica Fisica il valore più presente è il terzo (R=8.314) perchè utilizza unità internazionali; in questo caso nell'equazione di stato la pressione dovrà essere espressa in Pascal ed il volume in metri cubi. L'ugluaglianza espressa nell'equzione di stato viente mantenuta:
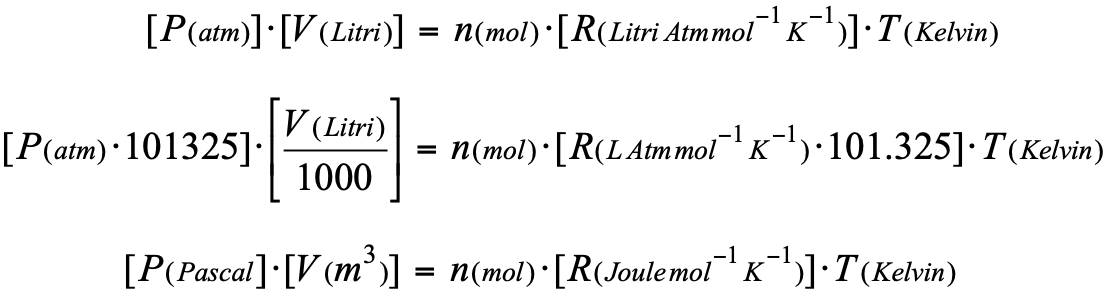
L'equazione di stato dei gas ideali include anche il principio di Avogadro: volumi uguali di gas diversi, nelle stesse condizioni di temperatura e pressione, contengono lo stesso numero di molecole. Infatti se il comportamento dei gas è ideale, se oltre a T e P sono uguali anche i volumi, il valore di n sarà ovviamente lo stesso.
| n | = | P V R T |
Definizioni:
Condizioni normali o Standard: la normalizzazione,
utilizzata per i gas, consiste nell'utilizzo della
temperatura di 273.15 K (0°C) e della pressione di una
atmosfera. L'ultima raccomandazione IUPAC sconsiglia di utilizzare il valore di una atmosfera e di sostituirlo con 100000 Pascal corrispndenti a 1 bar (unità non inclusa nel Sistema Internazionale).
Condizioni Standard (Wiki ITA) (link originale su internet)
Standard Condition (Wiki ENGLISH) (link originale su internet)
Volume molare: volume occupato da una mole (generico)
Volume molare a condizioni normali o Standard: volume occupato da una mole di gas ideale in condizioni standard [273.15 K (0 °C) e 100000 Pa (concidenti con 1 bar, unità del vecchio CGS e non del SI)]:
| VM(c.n.) | = | n R T P |
= | 1*8.3145*273.15 101325 |
= 0.022414 m3 = 22.414 Litri a 273.15 K e 1 atm |
| VM(c.n.) | = | n R T P |
= | 1*8.3145*273.15 100000 |
= 0.022711 m3 = 22.711 Litri a 273.15 K e 100000 Pa |
Una nota sui valori e sulle unità di misura di R
 Dall'equazione di stato è possibile ricavare R:
Dall'equazione di stato è possibile ricavare R:
| R | = | P V n T |
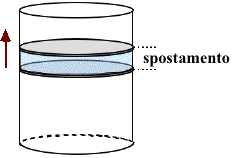
| P V | = | Forza Superficie |
× superficie × spostamento | = Forza × spostamento = lavoro |
|
1 Joule = 1 N m; 1 Litro = 10-3 m3; 1 atm = 101325 Pa (o Nw m-2). |
| 1 litro atm = 10-3 m3 × 101325 N m-2 = 101.325 N m = 101.325 Joule |
| R | = 0.082056 | Litri atm gradi mol |
= 0.082056 × 101.325 | Joule gradi mol |
Moltissimi dati in letteratura sono espressi in calorie e pertanto alle volte si usa R esprimendola in cal mol-1 K-1. Essendo 1 caloria = 4.184 Joule, sarà R = 1.9872 cal mol-1 K-1
Legge di Dalton delle pressioni parziali
Si supponga di avere, in un contenitore termostatato alla temperatura T e dal volume V, una miscela di tre gas a comportamento ideale. Ciascuno di essi occupa l'intero volume V del recipiente ed esercita una certa pressione, detta "pressione parziale", funzione del numero di moli con cui il gas partecipa nella miscela (distinguiamo i tre gas mediante numerazione sequenziale):
| (1) | P1V = n1 R T (per il gas 1) | ||||||||||
| (2) | P2V = n2 R T (per il gas 2) | ||||||||||
| (3) | P3V = n3 R T (per il gas 3) | ||||||||||
| Sommando membro a membro | |||||||||||
| (4) | (P1 + P2 + P3) V = (n1 + n2 + n3) R T | ||||||||||
| indicando con Pt la pressione totale risultante e con nt il numero di moli totali: | |||||||||||
| (5) | PtV = nt R T (per la miscela dei tre gas) | ||||||||||
| Dividendo la (1) per la (5) | |||||||||||
|
|||||||||||
P1 è la pressione parziale del gas(1) ed il suo valore è proporzionale a χ 1. Con χ 1 si intende la frazione molare del gas(1) ed è rappresentativa del contributo percentuale in moli del gas(1) nella miscela.
Espressioni analoghe si ottengono per gli altri componenti la miscela mediante lo stesso procedimento, cioè dividendo la (2) e la (3) sempre per la (5).
|
|||||||||||
|
La somma di tutte le singole frazioni molari di una miscela deve fornire la quantità unitaria (100% delle moli presenti). Nel caso dell'esempio proposto è facile da verificare:
| χ 1 + χ 2 + χ 3 = | n 1 n t |
+ | n 2 n t |
+ | n 3 n t |
= | n 1 + n 2 + n 3 n t |
= | n t n t |
= 1 |
La presenza di una miscela di gas in un contenitore può essere dovuta alla loro introduzione dall'esterno. Nel caso di gas che non reagiscono tra di loro, il numero di moli presenti nel contenitore corrisponderà al numero di moli introdotte. Nel caso in cui si verificano reazioni chimiche a carico dei gas presenti, il numero di moli di ciuscun gas presente dipenderà dal tipo di reazione e dalle condizioni sperimentali.
In un modo analogo all'introduzione della pressione parziale è possibile introdurre il concetto di volume parziale. In questo senso è come se si potesse obbligare ogni singolo gas della miscela ad occupare un volume, certamente minore di quello del recipiente V, in modo tale da produrre una pressione pari a quella totale. Il volume parziale di ogni singolo gas sarà proporzionale alla sua frazione molare. Così come la somma delle singole pressioni parziali conduce alla pressione totale, anche la somma dei volumi parziali conduce al volume "totale" del recipiente.
GAS REALI
- Le PARTICELLE non sono puntiformi ma hanno le dimensioni delle molecole che costituiscono la sostanza chimica gassosa (dimensioni dipendenti dal tipo di sostanza)
- Le PARTICELLE sono in continuo movimento (dotate di energia cinetica) praticamente come per il gas ideale.
- PRESENZA DI INTERAZIONI più o meno intense (dipendenti dalla natura chimica del gas)
- Gli urti non sono perfettamente ELASTICI ED ISTANTANEI (sia con altre particelle che contro le pareti)
DEVIAZIONE DEL FATTORE DI COMPRIMIBILITA'
L'equazione di stato dei gas ideali può essere scritta:
|
Pideale Videale /
n R T = 1.0
|
Per un gas ideale si può facilmente prevedere che,
mettendo in grafico il precedente rapporto in funzione della
pressione, si otterrà una retta parallela all'origine
con intercetta di valore unitario.
Utilizzando un gas reale e procedendo a misure sperimentali
dei parametri che compaiono nell'espressione, si ottengono
vistose deviazione che, per ogni singolo gas dipendono dalla
temperatura e pressione e, a parità di temperatura,
le deviazioni risultano diverse a seconda del gas utilizzato
nell'esperimento.
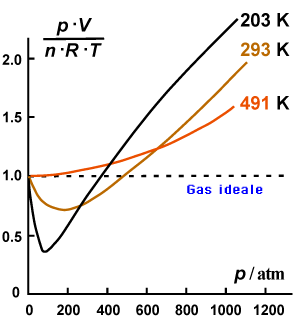
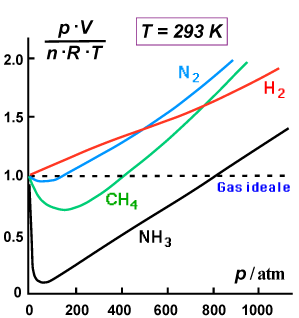
Nella figura seguente:
a) fattore di comprimibilità del gas metano in funzione della
temperatura;
b) fattore di comprimibilità (T= 293 K) per alcuni gas reali
 |
 |
|
(a)
|
(b)
|
- Le deviazioni sono tanto maggiori quanto maggiore è la pressione cui viene sottoposto il gas
- La tipologia e l'entità delle deviazioni variano da gas a gas
- A pressioni sufficientemente basse (< 10 atm e poco evidenti nelle due figure (a) e (b) a causa della scala) la deviazione dal comportamento ideale è tipicamente abbastanza piccola.
Come già detto e come chiaramente illustra la figura (a), le deviazioni dal comportamento ideale dipendono dalla temperatura. In particolare, all'aumentare della temperatura le deviazioni tendono ridursi. La conclusione più ovvia e che un gas reale può, a temperatura non troppo basse e a pressioni non troppo alte, essere trattato con discreta approssimazione come un gas ideale, nel senso che l'equazione dei gas ideali può essere utilizzata per prevedere il comportamento del gas con un errore abbastanza lieve.
La più concreta ed osservabile manifestazione della non idealità di un gas reale sta nel fatto che esso può essere reso liquido abbassando la temperatura e/o aumentando la pressione.
 L'equazione di Johannes Diderik van der Waals
L'equazione di Johannes Diderik van der Waals
(Leyden 1837 - Amsterdam 1923)
In ordine di tempo fu la prima equazione proposta per prevedere il comportamento dei gas reali. Si basa sul primo e terzo punto della definizione di gas reale data all'inizio di questa pagina. van der Waals, prese come riferimento l'equazione di stato dei gas ideali e propose due fondamentali correzioni: una derivante dal volume delle particelle che costituiscono il gas reale, e l'altra dovuta alle interazioni tra le molecole stesse.
NOTA: con il pedice "ideale" nella parte seguente si intende ciò che va sostituito nell'equazione dei gas "ideali"Correzione del volume
Il volume che le singole particelle "vedono" come a loro disposizione, non è il volume del recipiente che contiene il gas, ma quello "libero" che deve tenere conto del volume occupato da tutte le altre. Il volume "realmente" a disposizione del gas risulta così diminuito di una quantità b (detta covolume) che rappresenta, in prima approssimazione, il volume occupato da una mole di molecole di quello specifico gas. Il covolume risulta, pertanto, differente da gas a gas, in funzione delle specifiche dimensioni molecolari.
In breve:
Per un numero generico di moli n:
Correzione della pressione
La pressione che il gas riesce ad esercitare sulle pareti risulta inferiore a quella idealmente aspettata perchè le particelle tendono ad attrarsi le une con le altre. Risentendo di questa attrazione verso l'interno, le particelle urtano le pareti con minor vigore (pressione minore), ovvero, come si suol dire, il gas reale tende ad autocomprimersi. La pressione che noi misureremo (Pressione reale) sarà:
In breve, ordinando:
Il termine di pressione interna dipende dal quadrato della concentrazione (attrazione reciproca) e risente anch'esso dal tipo di gas con cui si lavora (coefficiente a tipico per ogni gas reale)
| Pideale = Preale + a | n 2 V 2 |
L'equazione di van der Waals completa:
| (P + a | n 2 V 2 |
) (V - n b) = n R T |
L'equazione riesce a prevedere abbastanza bene il comportamento del gas reale purchè lontani dalla zona in cui esso tende a liquefare (non si può pretendere di trattare un liquido come fosse un gas). In questa equazione compaiono due termini in blu, a e b, dipendenti dal tipo di gas. Il gas reale assume così una propria identità è un comportamento specifico a seconda delle sue caratteristiche chimiche e fisiche.
 |
L'equazione appare anche nel francobollo che gli venne dedicato. Fai click sulla miniatura di sinistra per un ingrandimento. |
Nella tabella seguente vengono messi a confronto due modi diversi di scrivere l'equazione di stato dei gas ideali con la corrispondente equazione per i gas reali secondo van der Waals (sono evidenziate le correzioni):
|
Ideale |
|
|
|
van der Waals |
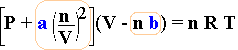
|
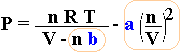
|
Nella tabella successiva vengono elencati i valori dei coefficienti a e b per alcune sostante gassose. Senza entrare in dettaglio facciamo notare che il gas reale che manifesta un comportamento quasi ideale è l'elio per il quale, infatti, i coefficienti a e b risultano essere molto piccoli.
Costanti di Van der Waals per alcune sostanze |
||
| Sostanza | a (L2 atm/mol2) | b (L/mol) |
| He (elio) | 0.0341 | 0.0237 |
| Ne (neon) | 0.211 | 0.0171 |
| Ar (argon) | 1.345 | 0.0322 |
| Kr (cripton) | 2.318 | 0.0398 |
| Xe (xenon) | 4.194 | 0.0511 |
| H2 | 0.244 | 0.0266 |
| O2 | 1.36 | 0.0380 |
| N2 | 1.39 | 0.0391 |
| CO | 1.48 | 0.0398 |
| CH4 | 2.25 | 0.0428 |
| CO2 | 3.59 | 0.0427 |
| NH3 | 4.17 | 0.0371 |
| H2O | 5.46 | 0.0305 |
| Cl2 | 5.5 | 0.049 |
| CCl4 | 20.4 | 0.1383 |
L'equazione di van der Waals prevede, al di sotto della temperatura critica di un gas reale, tre valori di pressione per un unico valore di volume. In realtà quello che si verifica per valori di temperatura inferiori alla critica è la liquefazione dell'aeriforme (vapore) per semplice compressione (piano di colore arancio come zona di equilibrio tra le due fasi ora presenti).
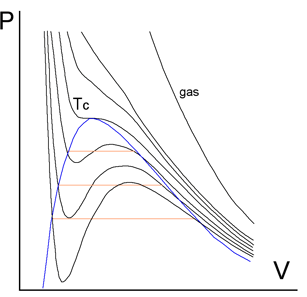
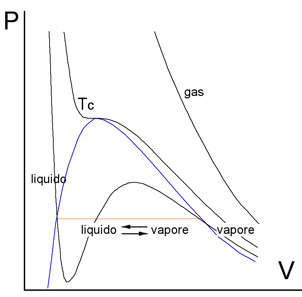
La figura che segue mostra il caso specifico del diossido di carbonio:
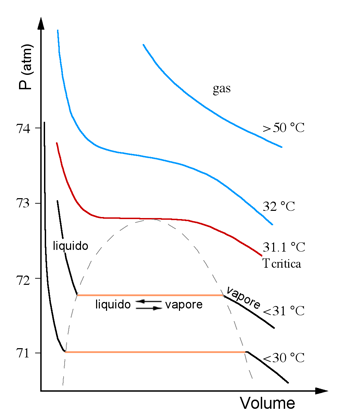
Al di sopra di una certa temperatura, diciamo maggiore di 50-60°C, le isoterme risultano praticamente dei rami di iperbole equilatera (comportamento quasi ideale). Per temperature inferiori gli andamenti tendono deviare vistosamente dalla forma iperbolica fino ad assumere un flesso perfettamente orizzontale per l’isoterma relativa alla temperatura che viene indicata come temperatura critica (curva colorata in rosso). Al disopra di questo valore di temperatura (curve azzurre) non è possibile liquefare il gas per semplice compressione, mentre per temperature inferiori, la compressione del gas (detto vapore) produce la formazione di CO2 liquida (piani arancione).
Consideriamo, ad esempio, la curva indicata con “<31°C” e supponiamo di trovarci nella zona lato "vapore". Comprimendo il gas si percorre la isoterma da destra verso sinistra; quando si entra dentro la campana tratteggiata in grigio comincia la liquefazione e, lungo tutto il piano colorato in arancione, avremo la contemporanea presenza del liquido e del suo vapore saturo. Per ulteriore compressione si raggiunge il limite sinistro della campana ed in quel punto tutto il gas è diventato liquido. Da questo momento in poi occorrerà aumentare di molto la pressione per ridurre di pochissimo il volume del liquido (pendenza elevatissima della curva "liquido").
NOTE Sui gas:
Simulazione delle distribuzioni di velocità (Maxwell-Boltzmann)(link applet java, non più esistente)
parametri ottimali per la simulazione precedente
number of atom: 100
Mass : 5
Diameter: 0.75
Temperature: non modificare
Mad speed=3*rms: non modificare
Distribuzione delle velocità in funzione della Temperatura (link file excel)
Distribuzione delle velocità in funzione delle masse molari(link file excel)
DIFFUSIONE ED EFFUSIONE (caso dei gas)
Il fenomeno della diffusione di un gas consiste nell'espansione-mescolamento di un gas verso un altro gas (o una miscela di gas es. aria) o espansione verso il vuoto. La diffusione (espansione) verso il vuoto è molto veloce perchè le molecole dei gas si muovono a velocità molto elevate mentre la diffusione-mescolamento contro un altro gas risulta macroscopicamente lenta.
Consideriamo due contenitori chiusi contenenti due gas diversi (rosso e verde) alla pressione di una atmosfera (1), con quello superiore capovolto. I due contenitori vengono aperti e rapidamente richiusi uno sull'altro mettendo a contatto le due aperture (2). La continua agitazione molecolare produrrà il mescolamento che non avverrà come una rapida espansione dei gas nei confronti del vuoto ma, a causa degli urti che ostacoleranno l'avanzamento dei due gas il mescolamento-diffusione avverrà in tempi piuttosto lunghi se non lo si aiuta mediante qualche tipo di agitazione (3).
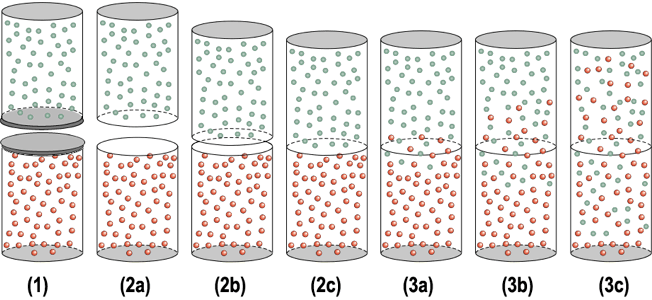
Alla temperatura di 25°C il mescolamento completo di due gas (1 atm) in due contenitori alti circa 25 cm, può richiedere un tempo superiore a 30 minuti in funzione delle dimensioni molecolari e da eventuali interazioni tra i gas.
Il contenitore superiore poteva essere già aperto e contenere quindi il gas aria. Non ho usato l'aria come esempio perchè, trattandosi di una miscela, avrebbe provocato una piccola confusione grafica a causa della necessità di distinguere azoto e ossigeno; il fenomeno si sarebbe verificato in maniera pressoché analoga.
Se il contenitore del gas rosso viene aperto a contatto con l'aria, si verificherà la diffusione-mescolamento con l'aria: dell'aria entrerà nel contenitore e del gas si diffonderà verso l'esterno e, se il gas rosso presenta un particolare odore, il nostro naso lo avvertirà dopo un po' di tempo. Il diffondersi di molecole odorose nell'aria spesso avviene abbastanza rapidamente perchè al normale processo di diffusione (lento) si aggiungono rimescolamenti macroscopici dovuti alla presenza di moti convettivi e ventilazioni di varia origine.
Link su youTube - Link su Rai Education
Il fenomeno chiamato effusione consiste nell'espansione di un gas attraverso un piccolo foro verso un contenitore in cui era stato fatto il vuoto. La quantità di gas che attraversa il foro nell'unità di tempo (intensità o velocità di efflusso) dipende dalla velocità quadratica media che è funzione diretta della temperatura e inversa della massa molecolare del gas. In particolare l'intensità di efflusso risulta inversamente proporzionale alla radice quadrata della sua massa molecolare (legge di Graham). Come conseguenza, Il rapporto tra le velocità di efflusso di due gas diversi, nelle stesse condizioni di temperatura e pressione, sarà uguale al rapporto inverso delle radici quadrate dei rispettivi pesi molecolari:
![]()
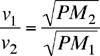
DENSITA' DEI GAS
Il principio di Avogadro (e l'equazione di stato dei gas ideali) afferma che volumi uguali di gas diversi nelle stesse condizioni di temperatura e pressione contengono lo stesso numero di particelle. Pertanto, se nello stesso recipiente (stesso volume) si misura la massa di due gas nelle stesse condizioni di temperatura e pressione, il rapporto delle masse ottenute risulterà uguale al rapporto delle densità ed equivale anche al rapporto delle masse delle singole particelle.
Per un gas a comportamento ideale:
| P V = | m(g) PM |
R T |
Isoliamo la pressione per evidenziare la densità (massa in grammi / volume in litri) del gas:
| P = | m(g) V |
1 PM |
R T |
da cui:
|
|
per due gas A e B nelle "stesse condizioni di temperatura e pressione" la densità dipende dal peso molecolare
|
|
Pertanto:
dA dB |
= | PMA PMB |
Ovvero: la densità relativa del gas A rispetto quella del gas B corrisponde al rapporto tra i pesi molecolari dei due gas.
L'esercitazione sul principio della mongolfiera è una applicazione del concetto della densità dei gas.
Decomposizione e/o dissociazione termica
Alcuni gas, già a temperature non troppo elevate ed altri a temperature fin troppo basse (es. AsCl5), tendono a produrre specie derivanti dalla rottura di particolari legami presenti nella molecola. In molti casi la dissociazione presenta carattere di reversibilità e conduce all'instaurarsi di un equilibrio il cui grado di avanzamento risulta dipendente dalla temperatura. Tratteremo la miscela gassosa derivante dalla dissociazione come un sistema "miscela di gas ideali".
Dal punto di vista analitico possiamo schematizzare la dissociazione nel modo seguente
AB 
A + B n.mol iniz. / n.mol iniz. (fraz. iniziale) 1 - - n.mol diss. / n.mol iniz. (fraz. dissociata) α - - n.mol formate / n.mol iniz. (fraz. formate) - α α n.mol all'equil. / n.mol iniz. (fraz. all'equil.) 1 - α α α per un generico numero di moli (n0) n0 (1-α) n0 α n0 α o molto più sinteticamente
AB 
A + B fraz.iniziale 1 - - fraz.dissociata α - - fraz.formate - α α fraz.all'equil. 1 - α α α per n0 moli n0 (1-α) n0 α n0 α
Il caso descritto consiste in una dissociazione dalla quale si formano un numero moli pari al doppio di quelle che si sono dissociate. Pertanto il numero di moli totali può essere determinato come funzione del grado di dissociazione:
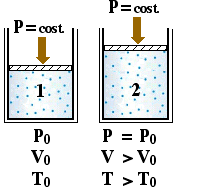
Una dissociazione termica può essere interpretata considerando un recipiente vuoto dentro il quale si inserisce una certa quantità di gas AB. Successivamente, in funzione della temperatura, si verifica la dissociazione. Un aumento di temperatura provoca un aumento del grado di dissociazione e, di conseguenza, si osserverà un aumento del numero di moli di particelle gassose. Il processo di incremento della temperatura può verificarsi a pressione costante o a volume costante.
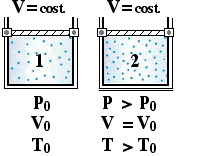 |
Aumento della temperatura a volume costante. |
 |
|
In qualunque modo si sia arrivati allo stato (2) si avranno dei ben definiti valori di Temperatura, Pressione, Volume ed un determinato valore per il grado di dissociazione. Se è possibile considerare ideale il comportamento della miscela gassosa sarà:
Isoliamo la pressione per evidenziare la densità della miscela gassosa:
| P = | m0 V |
(1+α) PMAB |
R T |
dove "V" è il volume occupato dalla miscela di gas, "n0" è il numero di moli iniziali del gas AB ora sostituto dal rapporto tra la massa iniziale del gas "m0" e il suo peso molecolare "PMAB". La densità della miscela gassosa vale:
| d = | m0 V |
= | P PMAB R T (1+α) |
(*) |
L'espressione usata in precedenza per ricavare il peso molecolare del gas che non si dissocia:
| PM = | d | R T P |
se usata in questo caso, fornisce un peso molecolare più piccolo di quello del gas AB e che corrisponderà con il PM medio tra le specie AB, A e B, e quindi dipendente dalla composizione della miscela. Il PM medio risulta pari al rapporto PMAB/(1+α) (vedi NOTA sul PM Medio):
| PMmedio = | d | R T P |
= | PMAB (1+α) |
Ciascun gas della miscela, alla temperatura dell'esperimento, contribuirà alla pressione in funzione del numero di moli con cui è presente, ovvero, come recita la legge di Dalton, proporzionalmente alla sua frazione molare. Indicando con n0 il numero di moli che inizialmente sono state introdotte del gas indissociato e con α il grado di dissociazione avremo (nota: le frazioni molari sono ricavabili come funzione del grado di dissociazione ricavabile dalla formula asteriscata):
| χA = | n.moli A n.moli totali |
= | n0 α n0 (1+α) |
= | α 1+α |
| χB = | n.moli B n.moli totali |
= | n0 α n0 (1+α) |
= | α 1+α |
| χAB = | n.moli AB n.moli totali |
= | n0 (1-α) n0 (1+α) |
= | 1-α 1+α |
pertanto
| Kp = | PA PB PAB |
= | χA P χB P χAB P |
= | P | χA χB χAB |
= | P | α2 1 - α2 |
Consideriamo ora un esempio in cui la stechiometria del processo è differente:
2 AB 
2 A + B2 fraz.iniziale 1 - - fraz.dissociata α - - fraz.formate - α α/2 fraz.all'equil. 1 - α α α/2 per n0 moli n0 (1-α) n0 α n0 α/2
In questo caso
La formula asteriscata (dalla quale, come già detto, potrebbe ricavarsi il grado di dissociazione) diventa:
| d = | m0 V |
= | P PMAB R T (1+0.5 α) |
(*) |
Le tre espressioni precedenti relative alle frazioni molari diventano:
| χA = | n.moli A n.moli totali |
= | n0 α n0 (1+0.5 α) |
= | α 1 + 0.5 α |
| χB = | n.moli B n.moli totali |
= | n0 α n0 2 (1+0.5 α) |
= | α 2 + α |
| χAB = | n.moli AB n.moli totali |
= | n0 (1-α) n0 (1+0.5 α) |
= | 1 - α 1 + 0.5 α |
Vista la relativa complessità formale delle espressioni ottenute non è conveniente sostituirle nella formula della costante di equilibrio. È meglio ricavare il relativo valore numerico e sostituirlo
| Kp = | PA2 PB PAB2 |
= | P | χA2 χB χAB2 |
Conclusione
Per una reazione di decomposizione termica in condizioni di equilibrio ad una certa temperatura, il grado di dissociazione, e quindi la composizione della miscela, dipendono dal valore della costante di equilibrio Kp. Se è nota la stechiometria del processo risulta facile correlare le frazioni molari dei componenti al valore del grado di dissociazione e quindi dedurre l'espressione della Kp in funzione della pressione totale del sistema e del grado di dissociazione.